2016年NgAgo技术的问世曾搅乱基因编辑的一湖池水,并掀起了惊涛骇浪而后续又饱受争议。那么NgAgo技术到底如何,南通大学刘东教授于2016年11月发表于CellRes杂志的一篇文章《NgAgo-basedfabp11ageneknockdowncauseseyedevelopmentaldefectsinzebrafish》似乎将笼罩于NgAgo技术的浓雾吹散了一些。
前几日刘教授在基因编辑学术研讨会上也以基于NgAgo技术敲低斑马鱼基因表达为题,做了细致的研究报道。

南通大学神经再生重点实验室刘东教授
刘东教授在NgAgo技术发现之初,确实是想利用该技术进行基因敲除。但是随着实验的开展,他想要完成的基因敲除(knockout)并没有实现,却意外收获了基因敲低(knockdown)这一结果。
基因敲除与敲低,虽然只有一字之差,但却是两个完全不同的学术概念。基因敲除是去掉不想要的基因,使目标基因永久性地表达沉默;而基因敲低则保留目标基因,只是阻断目标基因的表达,但在下一代生物体内依然能够进行基因表达。敲除是基因编辑的功能之一,而敲低则不是。
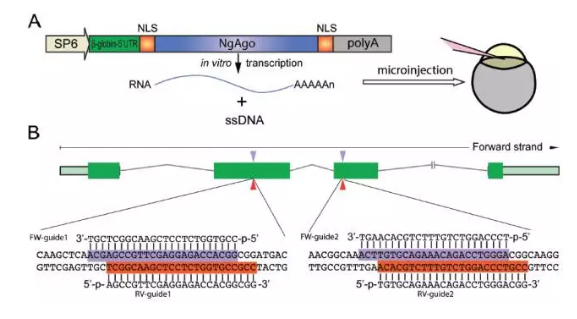
为了探索靶基因Fabp11a(脂肪酸结合蛋白11a,在调解葡萄糖和脂代谢稳态方面起着重要作用)对斑马鱼胚胎发育中的生物功能,设计了针对该基因的两条5'-磷酸化的ssDNA,并将其与优化过的NgAgo-2nlsmRNA一起注射到1细胞期的胚胎中。
另外,为了确保注射的NgAgomRNA能进入细胞核中表达NgAgo蛋白,研究者还专门在mRNA的两端增加了核内定位序列(NLS),而5’-磷酸化单链DNA专门靶向fabp11a的第二和第三个外显子——如果NgAgo能编辑基因,这两段基因序列会被改变。
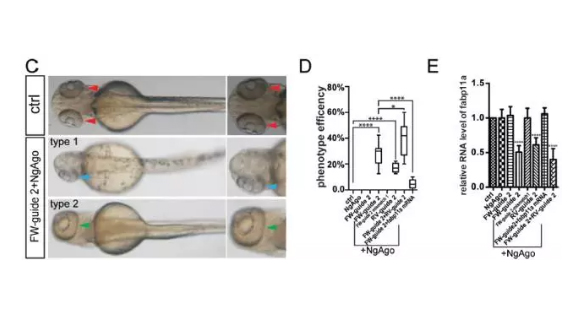
结果发现,注射过的胚胎中约有30%会在发育后出现两种眼部畸形的表型:眼部有一只相对小一点的眼睛而另一只显得十分小;或者两只眼睛融合形成一只较大的眼睛。
尽管该表型发生了变化,但是在抽提斑马鱼胚胎(正常/突变型)DNA并对靶基因进行扩增测序后,发现靶基因没有任何基因突变,但通过RT-PCR检测靶基因表达却有显著敲低。因而,刘东团队认为NgAgo系统确能导致斑马鱼表型改变(眼部发育缺陷),但是与靶基因的编辑无关,反是通过靶基因的敲减(knockdown)来行使功能。
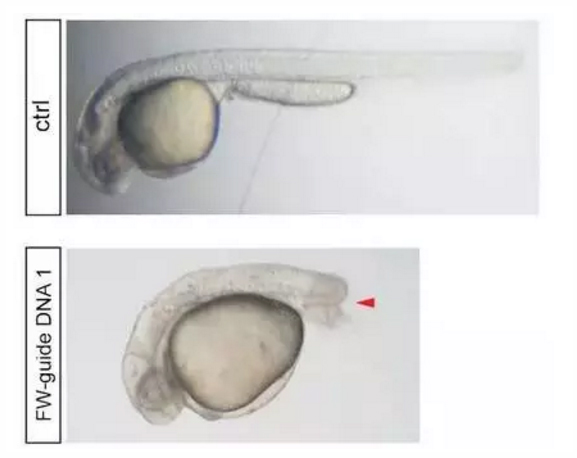
此外,为了确认gDNA/NgAgo系统在斑马鱼中敲低基因是一种普遍的现象,也测试斑马鱼中的其他四个基因(ta、kdrl、lama1和flt1)。以基因ta(决定斑马鱼有无尾巴性状)为例,研究结果发现约有30%注射过的胚胎出现没有尾巴的表型,这也证明了NgAgo技术的knockdown作用是具有普遍性的。
无独有偶,韩国科学家Jin-SooKim发表于论文预印本网站BioRxiv的文章《DNA-dependentRNAcleavagebytheNatronobacteriumgregoryiArgonaute》也认为NgAgo系统切割的是RNA,而不是DNA。

韩国研究者发现NgAgo蛋白具有DNA依赖的RNA酶活性(依赖于二价金属离子),且与NgAgo结合的DNA(gODNs)序列必须与RNA反向互补,而正义DNA(senseDNA)序列则不能引导NgAgo切割靶RNA。即当与NgAgo结合的DNA序列如果与RNA序列相同,则不能引导NgAgo切割靶RNA。
他们还发现gODNs的长度和序列会对NgAgo切割RNA效率产生影响。当gODNs长度低于13个核苷酸(nt)则完全不能介导NgAgo的RNA酶活性,而碱基错配会影响NgAgo的酶活性,尤其是第5-14nt(5’-3’方向)的碱基最为关键。因而,Kim的文章也从侧面呼应了在斑马鱼体内的实验结果。
而至于DNA序列对NgAgo系统的影响,刘东教授认为Kim的研究结果只能解释gODNs与RNA反向互补的情况。他指出即使NgAgo介导的DNA与mRNA的序列相同,也是存在基因下调活性的,只是活性比较低。但这与Kim等人的发现并不矛盾,他推测这可能是因为DNA介导的NgAgo还会与靶基因结合,抑制了目标DNA的转录造成的。
因而,相比于传统方法,NgAgo技术其敲低效率是比较高的,可作为RNAi以外的另一种基因敲低(knockdown)工具来使用。而且即便如此,关于NgAgo技术仍有一些有趣的东西没有研究清楚,需要进一步的探索。

以上则是刘东教授关于NgAgo技术研究的后续研究工作,同样他也希望能与其他研究团队合作一起挖掘并推动对NgAgo和其它该家族蛋白的新的兴趣点。





 浙公网安备33010802007965号
浙公网安备33010802007965号