尿路感染(UTI)是尿路上皮对细菌侵入导致的炎症反应。大多数情况下,尿路感染是由肠道内的大肠杆菌扩展至尿道中所导致。尿路感染会引起疼痛、排尿灼热和尿频。严重时,感染会进一步扩散到肾脏和血液中,从而危及生命。据统计,全球每年有1亿多人会患上尿路感染,尽管很多人会想到用抗生素治疗,但事实却是,约有四分之一的患者会在半年内复发。更糟糕的是,由于抗生素如今被肆意滥用,很多致病菌已经产生了抗性,抗生素的效果已越来越不明显。难题究竟该如何破解?
华盛顿大学医学院近日发表在Nature上的一篇论文给出了一个新解决方案:一种分子诱饵可以靶向作用于大肠杆菌,从而大大降低尿路感染的风险。
“开展本项研究的最终目标是帮助患者应对并预防复发性尿路感染,同时遏制抗生素耐药性这一全球性危机,”论文通讯作者、分子微生物学家ScottJ.Hultgren教授说,“这样一来,抛开抗生素去对付尿路感染便有了可能。”

ScottJ.Hultgren教授
说句公道话,大肠杆菌在肠道内本是无害的。然而,某些情况下,藏身于粪便中的大肠杆菌却有可能跑到尿道、膀胱里,结果带来了大麻烦。一般认为,尿路感染之所以会反复发作,是因为尿道里的病菌反复滋生所致。
研究人员于是琢磨开了:如果想办法减少肠道内可能带来危险的大肠杆菌的数量,便有机会降低得尿道感染的可能性,预防复发性感染。
经过仔细的分析,研究人员找到了一组负责编码菌毛的基因,大肠杆菌之所以能够在肠道内存活下去,一个很重要的原因便是其表面的菌毛使之能够附着在组织上,如同一种“分子搭扣”。没有了这种菌毛,肠道里的大肠杆菌脸皮再厚也呆不住。
早期的研究曾发现,这些菌毛能够附着在膀胱表面的甘露糖上。利用菌毛去牢牢抓住膀胱上的甘露糖受体,细菌就避免了在人们排尿时被赶出去。小鼠实验表明,一旦少了菌毛这件“利器”,细菌是无法导致尿路感染的。
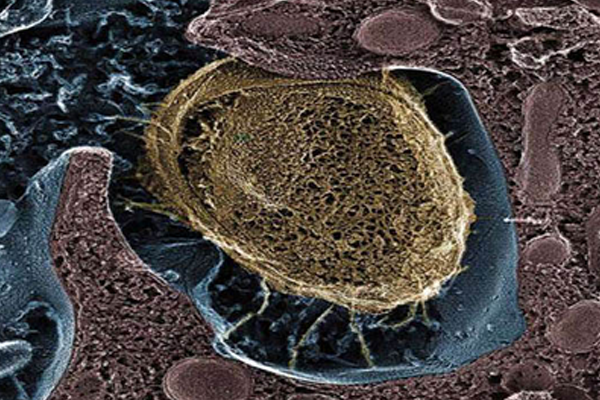
大肠杆菌附着在膀胱的内壁上
此前,Hultgren和本文作者之一、华盛顿大学生物化学和分子生物物理学副教授JamesW.Janetka通过化学修饰甘露糖,构建了一组甘露糖苷分子。这种分子与甘露糖颇为相似,但通过菌毛与细菌的结合性更强。不过与甘露糖不同,甘露糖苷不会死皮赖脸地缠着膀胱壁,如此一来,与甘露糖苷结合的细菌就会被尿液冲出去。
由于研究人员发现也正是因为这种菌毛细菌才得以附着于肠道上,因此,他们推断利用甘露糖苷,应该也能减少肠道中的大肠杆菌的数量,防止它们扩散至膀胱。
为了检验这个设想,研究人员将大肠杆菌的致病菌株引入了小鼠的膀胱和肠道内,以模拟人体内发生的情形。
接下来,研究人员给予了小鼠三次口服剂量的甘露糖苷,然后检测小鼠膀胱和尿道中的细菌的数量。结果令他们颇为惊喜:在膀胱中,致病菌几乎完全被清除掉了;在肠道中,数量也从原先的每个样本1亿个陡降至100万个。
“尽管我们没有将肠道内的致病菌铲除干净,但结果仍令人振奋,”论文第一作者CaitlinSpaulding说,“大幅减少肠道内致病菌的数量,意味着这些破坏分子进入尿道、引发尿路感染的机会就少多了。”
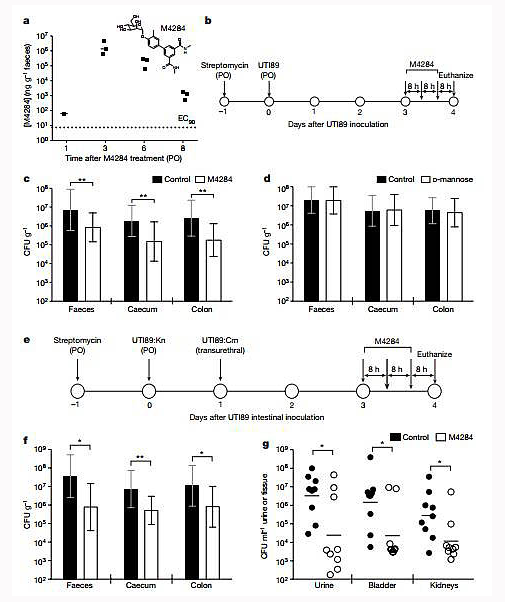
甘露糖苷减少了肠道内的大肠杆菌,对尿路感染有一定治疗效果
这里要指出一点,研究人员所研究的这种类型的菌毛,其实在大肠杆菌大多数菌株和其他一些相关细菌中亦有发现。理论上,如果用甘露糖苷去处理那些带有同样类型菌毛的细菌,就有可能将其清除,正如抗生素除了杀死目标菌,也会杀死其他细菌。消除无害细菌有可能导致危险菌趁机抢占地盘,引发肠道失调,而这恰恰是广谱抗生素治疗的一大风险。
幸运的是,研究人员检测了经过甘露糖苷治疗后肠道微生物的组成,结果发现:与引发尿路感染的致病菌相比,甘露糖苷对其他细菌的影响并不大。相比之下,如果改用抗生素去处理,微生物的丰度就大大不同了。
“这一发现激动人心,因为我们已经开发出了一种如同分子手术刀一般的治疗手段,”Spaulding说,“它能铲除你想干掉的那些细菌,同时又让微生物群落里的其他成员不受什么影响。”
显然,由于这种甘露糖苷并非抗生素,它有望被用来治疗由耐药菌引发的尿路感染。在美国,所开出的抗生素中,约有9%是用于对付尿路感染的,因此,这种避免使用抗生素治疗的方法有助于遏制抗生素耐药性的大肆传播。
尽管前景颇被看好,但我们仍需要保持审慎的乐观——本项研究的研究对象是小鼠,在人体能否取得同样的效果尚难预料。因此,要想真正用于医学实践,前面的路依然很长。





 浙公网安备33010802007965号
浙公网安备33010802007965号