在过去的几十年中,许多小鼠模型已被用于研究肠道微生物群及其与宿主的关系。先前的研究表明,肠道菌群有助于食物消化,从而使宿主获得不易消化的营养素,同时在宿主免疫、生理、代谢等方面也具有重要作用。到目前为止,仅有部分研究报道了肠道微生物对宿主脂代谢的影响,主要对转录表达谱和某些挑选的脂质分子的丰度进行分析,缺乏系统的研究。此外,一些报告的发现还是互相矛盾的。
近期《NatureCommunications》上发表了一篇转录组学+蛋白质组学+磷酸化蛋白质组学+脂质组学+16S rRNA基因测序的多组学研究,揭示了肠道微生物对肝脏脂质代谢的影响。小编迫不及待的要跟各位老师分享。

Nature Communications 12.353
研究结果
1. 转录组与蛋白组联合分析
作者对无菌小鼠模型(GF)和无特定病原体小鼠模型(SPF)的肝脏样本进行了转录组学和蛋白质组学分析。
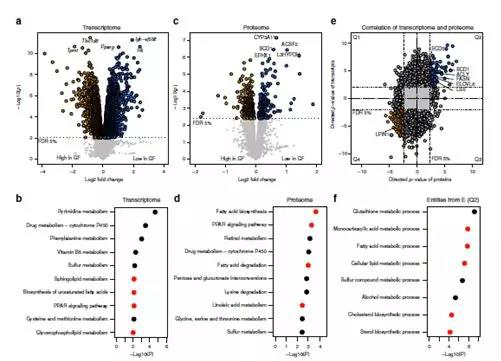
转录组学:总共分析了41174个探针,其中32308个可以定位到转录本,7769个探针显著差异表达(3937个基因)。通路富集分析揭示多个代谢通路在GF小鼠中显著富集,如药物代谢、脂质代谢。
蛋白质组学:共鉴定到5875个蛋白质,455个蛋白显著差异表达。KEGG通路分析显示差异表达的蛋白在亚油酸代谢、视黄醇代谢代谢等通路富集。
转录+蛋白联合分析:使用基因名称合并蛋白质组和转录组数据,以便识别在两个组学层中上调或下调的基因。两次组学同时鉴定到4843个基因,其中2822个基因(约58%)在GF和SPF共表达趋势一致,984个基因在SPF中持续高表达,1,838个基因在GF中持续高表达。蛋白质组和转录组基因功能富集分析显示SPF小鼠中上调的基因富集的8个GO生物过程中有5个参与脂质代谢。作者发现,影响脂质代谢的关键酶,如ACLY、FASN、SCD1和ELOVL6,在转录组与蛋白质组中均存在差异表达。
2. 磷酸化蛋白质组分析
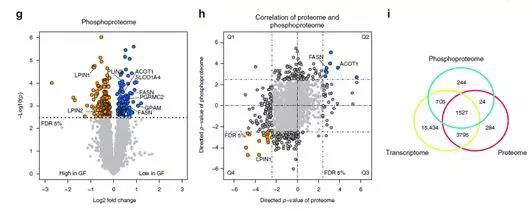
蛋白质磷酸化在酶的活化和失活中起重要作用。作者同时对GF和SPF小鼠的肝脏样品进行磷酸化蛋白质组分析。共鉴定到了5558个磷酸化肽段,其中1551个磷酸肽段,还可以检测到相应的蛋白质,1527个磷酸肽段在转录组、蛋白质组和磷酸化蛋白质组共同检测到。作者研究发现363种蛋白质在GF和SPF之间具有显著差异的磷酸化水平,其中,8种蛋白(ACOT1、FASN、GPAM、LPIN1 / 2、PGRMC2、PLIN3和SLCO1A4)参与到了脂质代谢。使用Uniprot KB标识符联合蛋白组学和磷酸化蛋白组学数据,作者鉴定到24个唯一蛋白,在蛋白表达量和磷酸化水平均具有显著差异的。
3. 脂质组学分析
作者对GF和SPF小鼠的血浆与肝脏样本进行了脂质组学分析。在鉴定到的525个脂质分子。肝脏中16种脂质分子和血浆中的15种脂质分子在GF和和SPF小鼠之间差异显著。最重要的是,作者发现SPF和GF小鼠之间存在从单不饱和脂质向多不饱和脂质系统转变的趋势。SPF小鼠中的棕榈油酸和含有单不饱和酰基链的甘油磷脂含量高出1.5倍,而在GF小鼠中,多不饱和脂肪酸和甘油磷脂的含量较高。
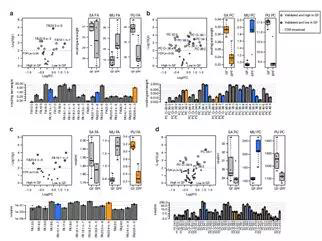
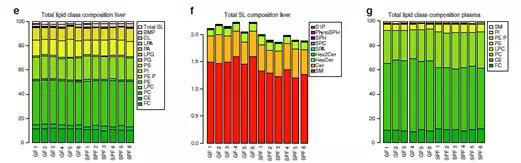
磷脂酰胆碱(PC,37%)、磷脂酰乙醇胺(PE,19%)、游离胆固醇(FC,11%)是肝脏中的主要脂质类别,鞘脂仅占肝脏脂质的一小部分,约占2%,不受肠道微生物的影响。血浆脂质则以磷脂酰胆碱(PC,27%)、胆固醇酯(CE,54%)和游离胆固醇(FC,10%)为主。肝脏和血浆中每种脂质亚类的总浓度没有差异。
总而言之,上述数据表明肠道微生物群影响肝脏和血浆中特定的脂肪酸和甘油磷脂分子。含有肠道微生物群的小鼠会较高比例的含有单不饱和脂肪酸(MUFA),而GF小鼠以脂质饱和脂肪酸(SAFA)和多不饱和脂肪酸(PUFA)为主。
4. 组学数据重建脂代谢途径
作者根据组学数据重建了脂肪酸代谢途径,并对肝脏脂质代谢过程进行了系统的描述。作者在3个特定的脂肪酸转化步骤中观察到GF和SPF小鼠之间的显著差异:(I)ACAC A / B和FASN参与的乙酰-CoA从头合成脂肪酸的过程; (II)SCD1参与的棕榈酸酯(FA16:0)去饱和为棕榈油酸酯(FA16:1 n-7)过程; (III)ELOVL5参与的FA18:3 n-6延伸至FA20:3 n-6的过程。为了支持(II)和(III),作者将脂肪酸产物/前体比率与相应的mRNA或蛋白质丰度相关联。结果显示SCD1表达量与16:1 n -7 / FA16:0比率、ELOVL5表达量与20:3 n-6/18:3 n -6的比率均强相关。
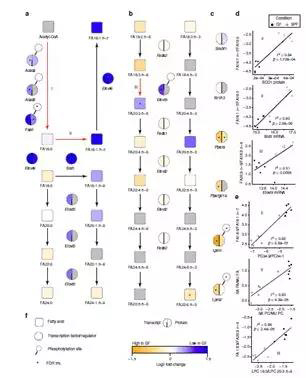
此外,作者还发现脂肪酸产物/前体水平的比值与PC和LPC脂质分子对应的去饱和度和链伸长指数高度相关,表明FA代谢过程的改变清楚地反映在甘油酯的酰基表达谱中。
5. 基于脂肪酸表达谱的综合分类得分
为提供更多的肠道微生物特异性调节脂代谢过程的证据,作者对SPF的肠道微生态进行短期的抗生素处理(氨苄青霉素(A)、万古霉素(V)、甲硝唑(M)、或万古霉素(V)和甲硝唑(M)的组合),并对肝脏的脂肪酸进行了检测。
作者发现FA 16:0、FA 20:3 n-6、FA20:4 n-6和FA 22:6 n-3几种脂肪酸的组合不但能够清楚地将GF与SPF小鼠区分开,也可将不同抗生素处理与未处理的小鼠区分开。Scd1和Elovl5的mRNA表达水平在低评分样本有低表达水平。这些结果表明肠道微生物群影响脂肪酸代谢,特别是由SCD1和ELOVL5产生的脂肪酸。
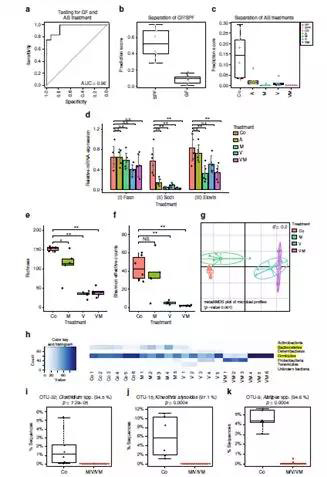
6. 肠道微生物组成分析
为了确定抗生素对肠道微生物群多样性和组成的影响,作者进行了16S rRNA基因测序分析。结果表明所有抗生素均影响α多样性,与单独的M相比,V和VM的组合具有特别显著的影响,β多样性分析揭示了V和VM样品与对照组能够明显区分,但是彼此间区分并不明显。对比M,V几乎完全消灭了拟杆菌(样品V1除外),并且杆菌仅存在于用V处理的小鼠中。受抗生素影响最大的OTU是OTU-32(厚壁菌),OTU-15(厚壁菌)和OTU-9(拟杆菌)。
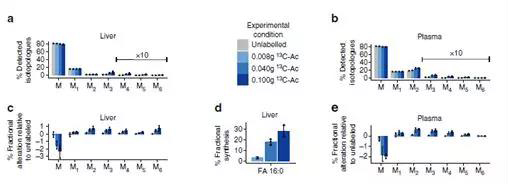
7. 乙酸是肝脏脂质合成的前体
厚壁菌和拟杆菌能够将膳食多糖从纤维降解为短链脂肪酸(SCFA),包括醋酸盐(FA 2:0),通过门静脉到达肝脏。为了弄清楚源自肠腔的FA 2:0是否是肝脏中长链脂肪酸合成的前体,对小鼠用不同浓度的13C标记的FA 2:0进行了口服灌胃实验。4小时之后对肝脏和血浆中FA16:0进行了检测。结果表明口服13C-FA 2:0之后,肝脏和血浆中FA 16:0的同位素M2-M6丰度以剂量依赖性方式明显增强,单同位素M0减少。并且新合成的FA16:0的比例从4%增加至30%,表明肠源性乙酸能够刺激肝脏FA从头合成。
为了证明GF和定殖小鼠的脂质谱的差异,特别是改变的MUFA可能与肠道中微生物FA 2:0的产生有关。SPF小鼠接受2天万古霉素和甲硝唑(VM)组合处理后(TP2),然后饲喂不含抗生素的常规饲料2天(TP4)或10天(TP14)。抗生素处理引起了微生物组成和多样性下降,厚壁菌和拟杆菌几乎被完全消除,门静脉FA 2:0浓度减少两倍。去除抗生素(TP4和TP14)后,肠道微生物生态系统恢复,达到基线FA 2:0水平(TP0)。重要的是,肝脏和血浆MUFA(16:1 n-7,FA 18:1 n-9,18:1 n-7),MUPC(PC 34:1,PC 36:1)和PUFA(20:3 n-6,22:6 n-3)水平的变化也遵循这一趋势。这些结果表明肝脏和血浆FA水平与肠道微生物SCFA产生菌和门静脉血液FA 2:0水平的直接关系。
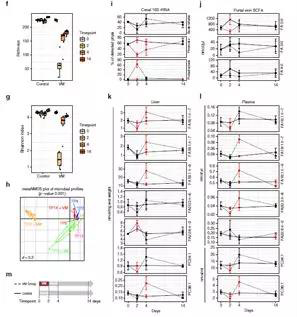
为了证明肝脏MUFA的合成依赖于肠道微生物对膳食纤维的降解,GF和SPF小鼠饮食中的粗纤维被5%精制的纤维素代替。精制的纤维素实际上是不可降解的,导致门静脉血液中SCFA水平显着降低。与喂食常规饲料的小鼠相反,喂食含有纤维素的GF和SPF小鼠的血浆和肝脏FA曲线没有显着差异。这些结果证实,在SPF小鼠中观察到的脂质代谢差异,特别是MUFA的产生,依赖于可降解的纤维来源。SPF小鼠喂食含有14%纤维的对照饮食,含有更高水平的MUFA,但是与喂食具有5%纤维的饮食相比,PUFA含量更低。总之,这些数据提供了强有力的证据,即肠道微生物通过合成C16和C18脂肪酸的前体物质乙酸(FA 2:0)来促进肝脏FA代谢。
结论
作者的研究证实了肠道微生物的定殖能够促进肝脏FA代谢,这也反映在甘油磷脂分子的酰基变化中。肝脏长链FA的重要前体是肠道微生物降解膳食纤维产生的FA2:0(乙酸)。肠道微生物的定殖驱动宿主脂质代谢改变,可能不仅影响生物物理膜特性,还影响信号过程,例如类花生酸生成,因此影响宿主生理学以及炎症和代谢性疾病的生成有关。





 浙公网安备33010802007965号
浙公网安备33010802007965号