生物过程具有复杂性和整体性,单一组学的数据难以系统全面地解析疾病发生发展的复杂机制。转录和代谢联合分析可以同时实现从“因”和“果”两个方向来探究生物学问题,相互间进行验证,从海量的数据中筛选出关键基因、代谢物及代谢通路开展后续深入研究与应用,从而提高文章的水平。
A Comprehensive Analysis of Metabolomics and Transcriptomics in Cervical Cancer
宫颈癌的代谢组学和转录组学联合分析
01
研究背景
宫颈癌(CC),是发展中国家女性常见的恶性肿瘤之一,是严重威胁妇女生命的杀手。宫颈癌的筛查和早期诊断对预后至关重要。今天分享的这篇文章通过对宫颈癌患者及健康对照(NOR)的血浆样本进行代谢组学和转录组学联合分析,以探索宫颈癌的代谢特征和潜在的诊断生物标志物,从而为CC的诊断和筛查开辟一条新通路。
02
研究样本
根据入组时间将代谢组数据分为训练集和测试集。训练集包括70个CC和80个NOR病例,测试集包括66个CC和69个NOR病例。转录组数据包括28个CC和24个NOR病例。
03
研究思路
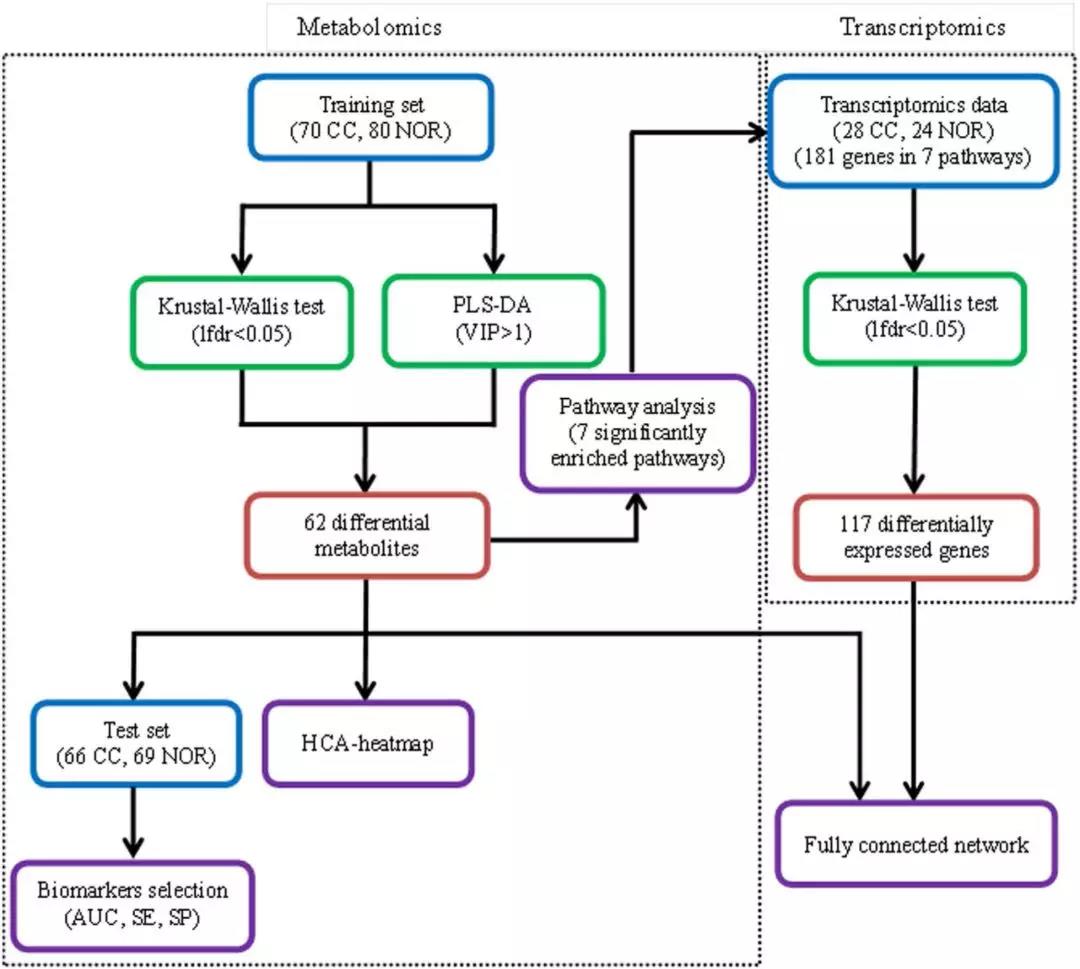
04
研究结果
1. CC和NOR的代谢特征分析
本研究采用非靶向液相色谱-质谱联用技术进行代谢组学检测。ESI+模式下检测到3495个信号,ESI-模式下检测到3052个信号。ESI+和ESI-模式下所有样品的二维PCA得分图(图1)在本研究中没有显示异常值,紧密聚类的QC样品确保了检测稳定性。
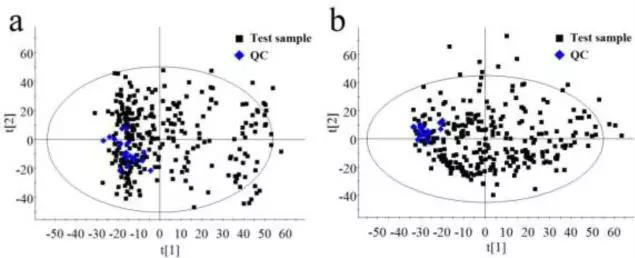
图1
2. CC和NOR之间的差异代谢物
基于LFDR<0.05,VIP>1两个标准,在ESI+模式下鉴定到34个代谢产物,ESI-模式下鉴定到28个代谢产物。CC患者中55种代谢物下调,7种代谢物上调。图2显示了CC和NOR之间62种不同代谢物的HCA热图。在HCA热图中,CC与NOR明显分离。
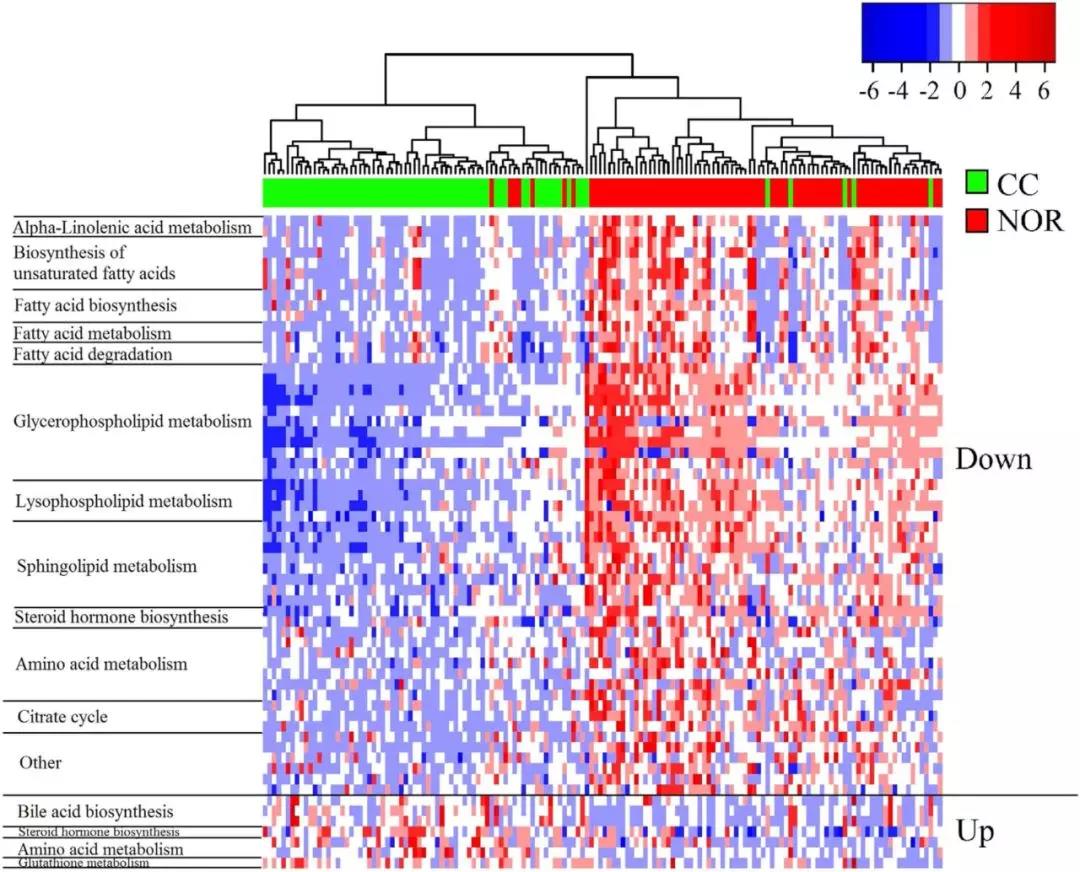 图2
图2
3. 宫颈癌诊断的生物标志物
为了选择合适的宫颈癌诊断代谢物,研究者首先利用皮尔逊相关系数将代谢物聚类为共调节组,共获得5个聚类。然后选择每个聚类中AUC值最大的代谢物作为候选生物标志物,包括胆红素、溶血酶C(17:0)、N-油酰苏氨酸、12-羟基十二酸、四碳六烯酸。计算这些生物标志物组合的AUC值、敏感性(SE)和特异性(SP)来描述其对CC和NOR的诊断准确性(表1)。
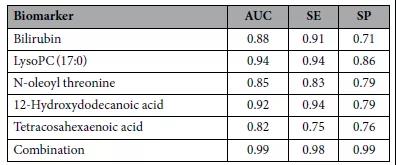
表1
4. 通路分析
对定性到的62个差异代谢物,进行KEGG通路富集分析,共富集到31条通路(图3)。基于P < 0.1,筛选到7条显著富集的通路,包括脂肪酸生物合成、乙醛酸和二羧酸代谢、柠檬酸循环、赖氨酸生物合成、组氨酸代谢、赖氨酸降解和类固醇激素生物合成。这些通路主要涉及碳水化合物代谢(柠檬酸循环、乙醛酸和二羧酸代谢)、脂质代谢(脂肪酸生物合成、类固醇激素生物合成)和氨基酸代谢(赖氨酸生物合成、组氨酸代谢、赖氨酸降解),在肿瘤组织的快速生长和癌细胞的转移中起着重要作用。
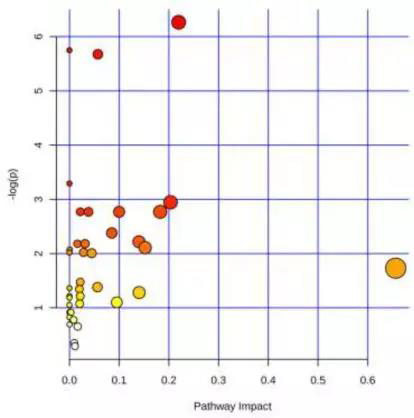
图3
5. 转录组学数据分析
研究者进一步分析了P < 0.1的7个通路中的基因。在总共181个基因中,117个基因(64.64%)差异表达(FDR<0.05),其中大多数基因(91,77.78%)具有催化活性(图4a)。进一步分析具有催化活性的基因的分子功能,发现它们主要参与氧化还原酶活性(45,49.45%)、转移酶活性(33,36.26%)和连接酶活性(12,13,19%)(图4b)。

6. 差异代谢物和基因的网络分析
研究者用metscape建立了7个显著富集通路中代谢物和基因的连接网络(图5)。尽管研究中的代谢组学和转录组学数据来自不同的群体和技术平台,但在这些通路的网络中发现许多相同通路的代谢物和基因存在差异。该结果可以进一步提高前面选择的代谢物,基因和通路的可信度。
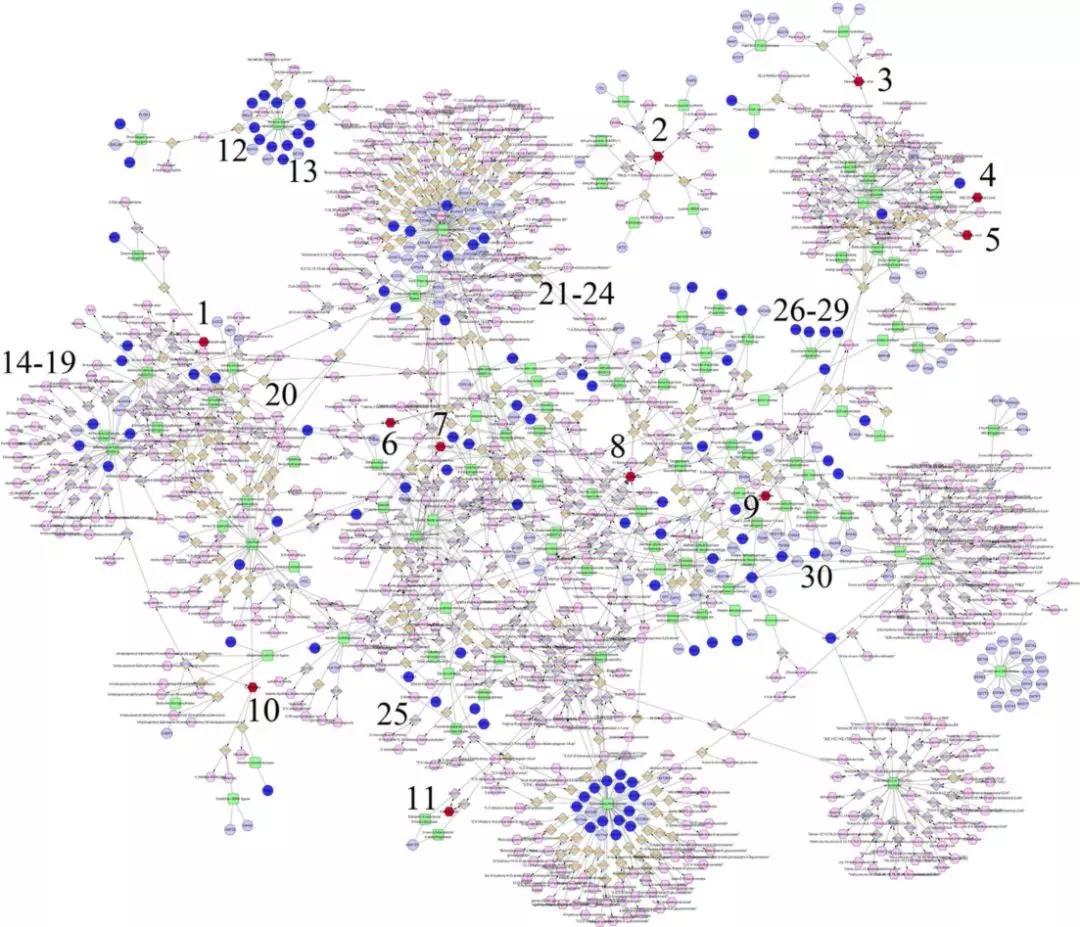
图5
总结
本研究在转录和代谢水平上解释了宫颈癌的异常代谢,探讨了关键基因在癌症中的作用,并证明代谢组学和转录组学的联合分析是研究癌症发生机制和发现更可靠生物标志物的一种有效方法。
原创: 任胜景 迈维医学





 浙公网安备33010802007965号
浙公网安备33010802007965号