Microbiome–metabolomics reveals gut microbiota associated with glycine‑conjugated metabolites and polyamine metabolism in chronic kidney disease★★★★★
● 期刊:Cellular and Molecular Life Sciences
● IF=7.02
● 发表时间:2019-05-16
研究背景
随着发病率和死亡率的增加,慢性肾病已成为一个主要的公共卫生问题。慢性肾病患者患心血管疾病的风险高于传统的风险因素。血管紧张素转换酶抑制剂和血管紧张素受体阻滞剂被认为是第一线治疗方法,证明能有效延缓高血压、心血管疾病和慢性肾病的进展。然而,许多使用这些药物治疗的慢性肾病患者还是会发展为终末期肾病(ESRD),这突出了新疗法对疾病干预的重要性。
各种临床和动物研究已经证明肠道微生物群在健康维持和疾病发病机制中的关键作用。通过改变肠道的生化和生物物理环境,晚期慢性肾病会导致肠上皮屏障破坏和微生物生物失调。最近的研究阐明了慢性肾病对指向肾-肠轴的肠道微生物群的影响。慢性肾脏病已被证明导致肠道微生物群落的生物失调。对肠道微生物组-代谢组轴的更深入理解是改善慢性肾病发展过程中控制肠道微生物组的治疗策略的先决条件。
研究方法
LC-MS/MS广筛及靶向检测、western blot、16s RNA、临床指标
研究思路
一、构建假手术组(sham)和肾脏切除组(NX)模型,收集样本。临床指标检测、血清样本LC-MS代谢组检测、肠道样本16s RNA检测。关联分析,锁定相关通路。
二、构建假手术组(sham)、肾脏切除组(NX)、肾脏切除给予茯苓组(NX+PC)以及肾脏切给予茯苓提取物组(NX+PAA)模型,靶向检测上述通路中的物质,配合WB验证。
研究结果
慢性肾病大鼠肠道菌群结构发生改变
与假手术组相比,慢性肾病大鼠的尿量、收缩压(SBP)、舒张压(DBP)、血清肌酸酐、尿素和蛋白尿显著增加,而体重、肌酸酐清除率(CCr)和血细胞比容明显降低(图1a)。
16s结果显示,sham组和NX组之间肠道菌群组成存在显著差异(图1b-c)。sham组和NX组从门到属水平之间的差异(图1d)。sham组和NX组的微生物群落主要由厚壁菌门和拟杆菌门组成,它们是鼠的典型肠道微生物群落结构(图1e)。厚壁菌和拟杆菌属分别占sham组和NX组肠道细菌序列的71.1%、65.8%以及19.9%、27.5%。在低水平(低于3%)检测到包括放线菌、变形菌等其他门群(图1e)。NX组中变形菌丰度增加。在纲水平上,NX组β变形菌明显增加,而α变形菌明显减少(图1f)。
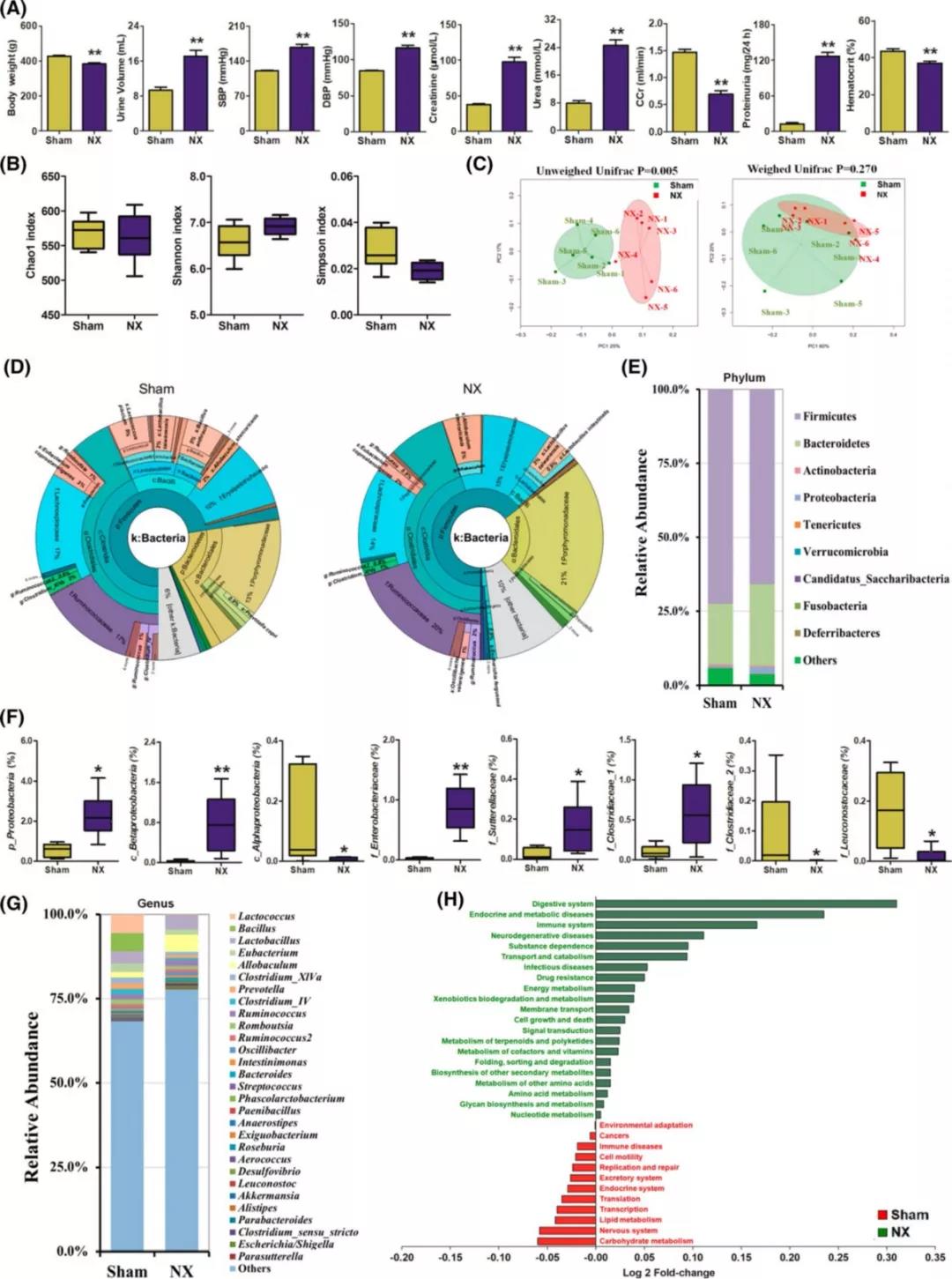
图1
慢性肾病大鼠肠道分类群的变化
在属水平上,每个样品平均72.3%的序列不能被注释(图1g),与之前的报道一致。其余序列属于91个属,其中乳杆菌属、真细菌属、异杆菌属、梭状芽孢杆菌属、普雷沃氏菌属、梭状芽孢杆菌属、乳米诺球菌属和罗勃氏菌属在两组中都非常丰富(图1g)。PICRUSt分析预测,肠道微生物群的改变影响的代谢途径(图1h)。
LEfSe分析显示NX组的主要特征是异杆菌属、埃希氏志贺氏菌属、梭菌属、拟杆菌属、乳球菌属、布拉氏球菌属和肠杆菌属的丰度较高(LDA> 2.0,P < 0.05),而sham组主要表现为假单胞菌属、嗜碱菌属、明串珠菌属、乳球菌属和梭菌属ⅳ的丰度较高(LDA> 2.0,P < 0.05,图2a,b)。OPLS-DA显示,这些菌群可以显著地将sham组与NX组分开(图2c)。皮尔逊相关分析确定了几个与NX组密切相关的分类群(图2d)。为了确定NX组中生物化学参数与肠道菌群变化之间的相关性,对改变的13个肠道菌群和生物参数进行了斯皮曼相关分析。发现CCr和SBP与肠道微生物群的改变有很大关系(图2e)。在相关网络中进一步观察慢性肾病相关的13个属以及9个生理生化参数之间的斯皮曼相关性(图2f)。发现SBP和CCr是整个网络的中枢,为生理参数和属产生了两个子网络(图2f)。结果表明,蛋白尿增加与红细胞压积降低之间的显著正相关,与CCr无关。综上所述,这些结果表明肾功能不全可能影响肠道菌群的结构和组成。反过来,肠道菌群失调在肾功能受损的恶化中起着至关重要的作用。
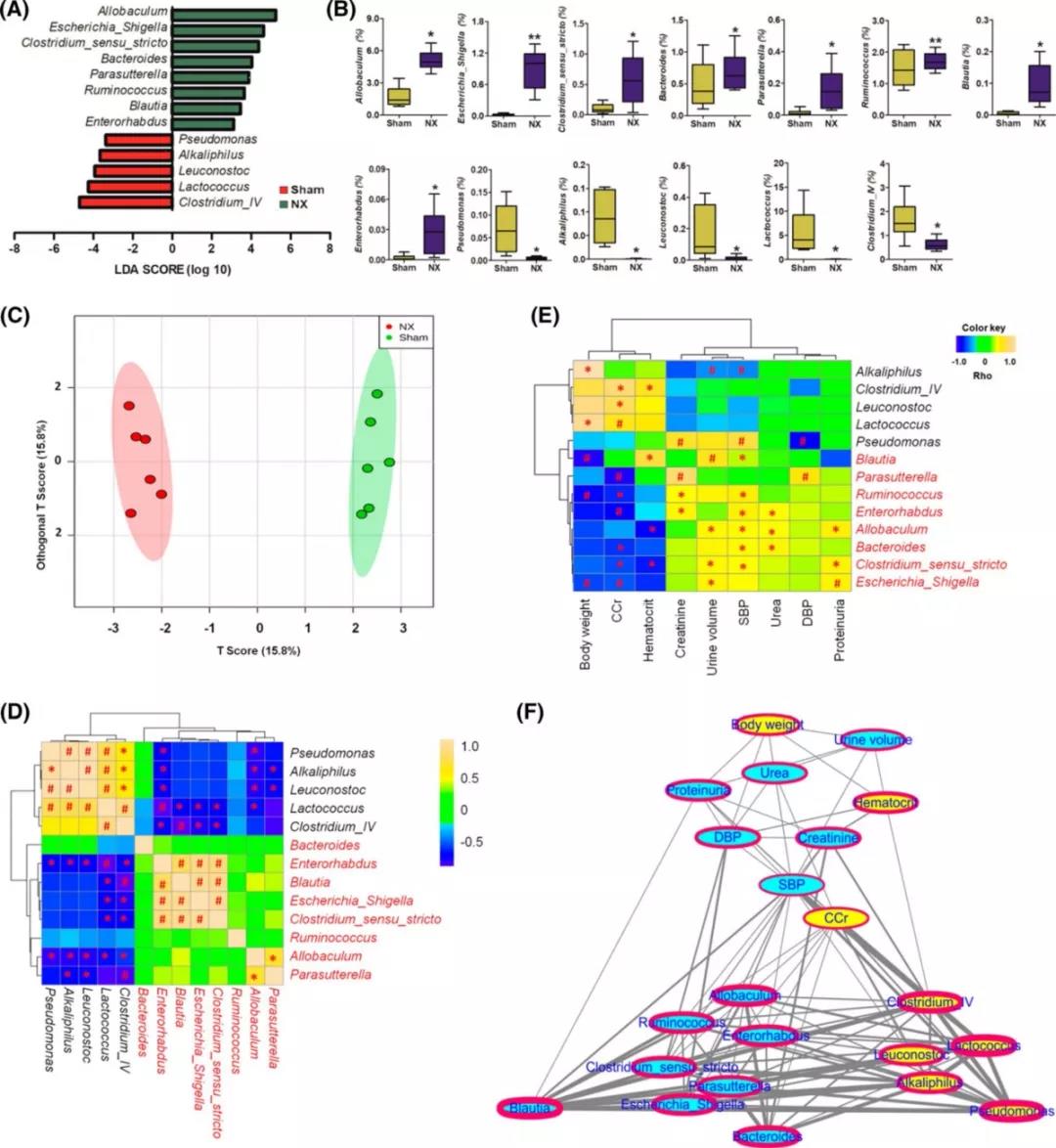 图2
图2
慢性肾病引起肠道微生物群改变对潜在功能的影响
为了预测慢性肾病大鼠肠道微生物群改变的可能影响,通过PICRUSt 分析,OTUs被分配到数据库中最近的参考基因组。PICRUSt分析显示,471KEGG orthology(KO)与219个改变的代谢途径相关,例如脂质生物合成和代谢(鞘脂、脂肪酸、类固醇、胆汁酸)、氨基酸生物合成和代谢(缬氨酸、亮氨酸、异亮氨酸生物合成、苯丙氨酸、酪氨酸、色氨酸和组氨酸)、氨基苯甲酸酯降解、苯丙素生物合成和MAPK信号途径,它们与37种酶相关。代谢途径和相关酶参与了33条代谢途径的交替(图1h)。肠道微生物群参与尿毒症毒素的产生,包括对甲酚硫酸盐(PCS)和吲哚酚硫酸盐(IS),后者对全身炎症、肠道屏障结构/功能的损害和慢性肾病的进展有很大作用。肠道微生物可以将磷脂酰胆碱和左旋肉碱转化为三甲胺,三甲胺被肝黄素单加氧酶代谢为三甲胺氮氧化物(TMAO),最终由肾脏排出。TMAO与肾纤维化、慢性肾病进展及其并发症如动脉粥样硬化和心血管疾病密切相关。
慢性肾病大鼠血清代谢组学的变化
代谢组结果,OPLS-DA显示sham组与NX组有明显区分(图3a)。291个被鉴定的代谢物也可以很好的区分sham组与NX组(图3d-f)。如图3g所示,这些代谢物主要参与脂肪酸代谢(支链脂肪酸氧化、亚油酸、脂肪酰基辅酶a生物合成)、氨基酸代谢(色氨酸、酪氨酸、苯丙氨酸、组氨酸、赖氨酸、脯氨酸等)、多胺代谢(亚精胺和精胺生物合成)和嘌呤代谢。值得注意的是,大多数代谢途径与肠道微生物代谢有关,表明慢性肾病大鼠肠道微生物失调。此外,途径相关的代谢网络表明代谢途径的失调也与甲基组氨酸、苯丙氨酸、酪氨酸、甘氨酸、丝氨酸、色氨酸和丁酸的代谢以及亚精胺、精胺、磷脂和脂肪酸的生物合成有关。总之,慢性肾病与氨基酸、多胺和脂质代谢的改变密切相关。
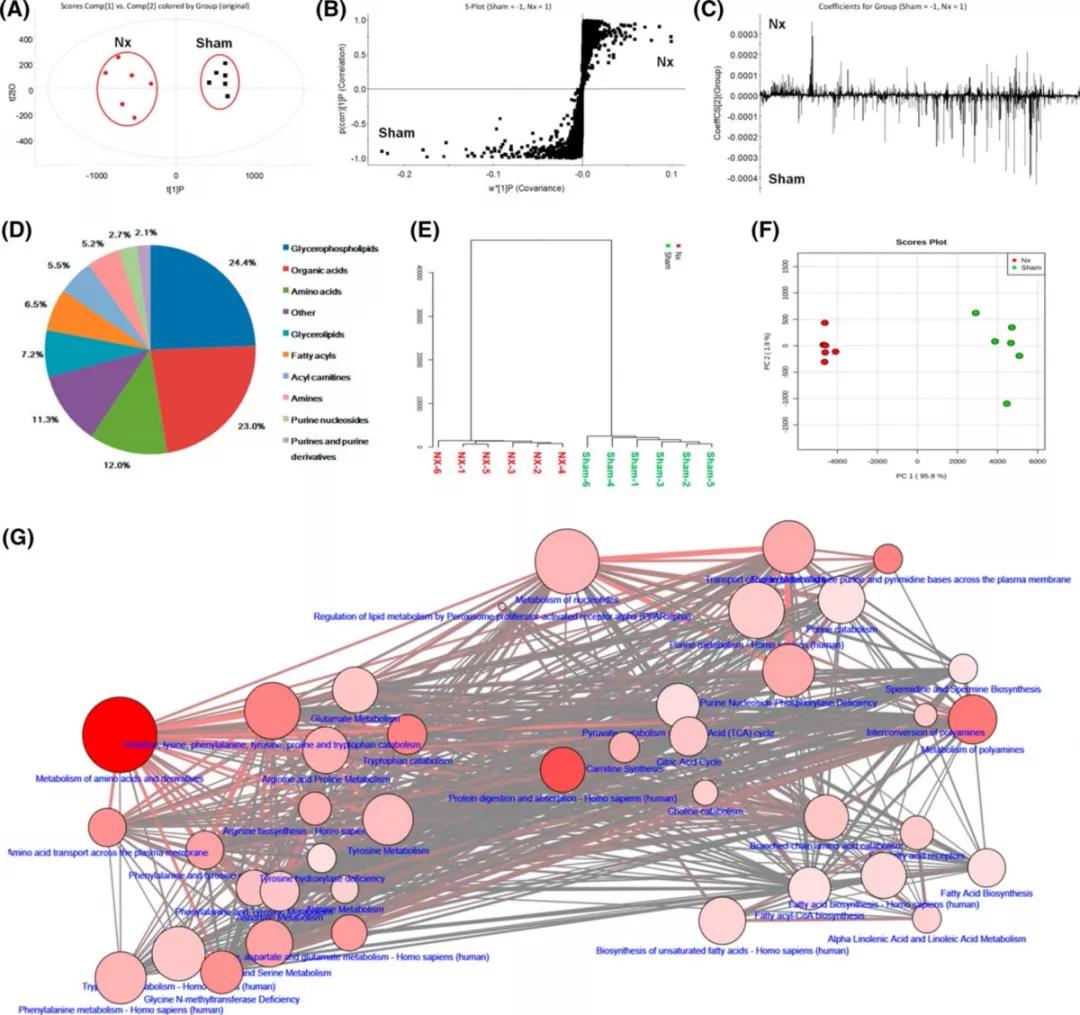 图三
图三
慢性肾病诱导的肠道菌群与代谢失调的关系
对发病机制中的微生物菌群和代谢物进行斯皮尔曼相关分析。如图4a所示,36种代谢物与13个改变的微生物属显著相关。酪氨酸和色氨酸的减少与梭菌ⅳ呈正相关,与Allobaculum、Clostridium_sensu_ stricto、埃希氏志贺氏菌、肠杆菌和布拉氏菌呈负相关。大多数代谢物如TMAO、甘氨酸、肉桂酰甘氨酸、苯乙酰甘氨酸、苯丙酰甘氨酸、精胺、亚精胺、丙烯醛、腐胺和N1-乙酰精胺在NX组中明显增加,并与Clostridium_sensu_stricto、埃希氏志贺氏菌、肠杆菌属、Parasutterella和布拉氏菌属呈正相关,它们含有编码参与甘氨酸结合代谢物和多胺代谢的酶的基因。
SBP和36种代谢物进行斯皮尔曼相关分析,显示SBP与16种代谢物有关。有趣的是,十种化合物,如肉桂酰甘氨酸、2-苯乙酸、苯乙酰甘氨酸、苯丙酰甘氨酸和马尿酸,是甘氨酸缀合的微生物代谢物(图4c)。例如,马尿酸是由苯甲酸和甘氨酸结合产生的,这种反应发生在肝、肾和肠中。甘氨酸可以直接与苯丙酸偶联,苯丙酸是厌氧菌的一种已知代谢副产物。这些发现表明甘氨酸的生物活性部分与慢性肾脏病引起的高血压有关。甘氨酸共轭代谢物包括肉桂酰甘氨酸、苯丙酰甘氨酸、2-苯乙酸和马尿酸的增加与埃希氏志贺氏菌、肠杆菌属、Parasutterella和拟杆菌属呈强正相关,与梭菌ⅳ呈强负相关。
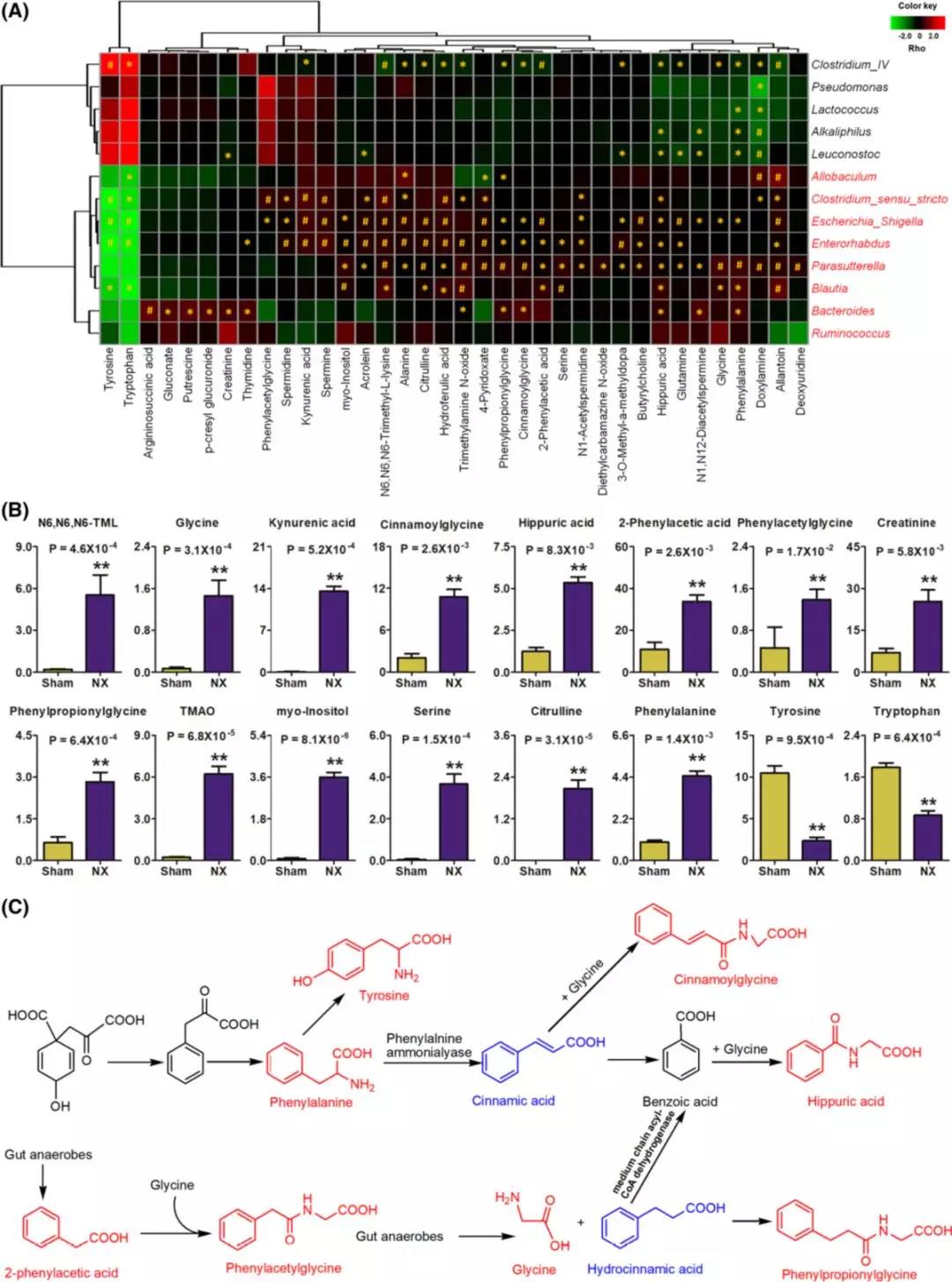
图4
代谢网络建模和肠道菌群—代谢物——表型轴中微生物群和代谢物的关联
为了评估肾功能对代谢物的潜在作用,我们使用肠道微生物群相关的36种代谢物对CCr和代谢物进行了Spearman相关和线性回归分析。15种代谢物显示与CCr显著相关,线性回归系数大于0.800(图5a)。值得注意的是,这些代谢物属于多胺代谢(精胺、亚精胺、丙烯醛、腐胺、3-氨基丙醛、N1-乙酰精胺和N1,N12-二乙酰基精胺)。多胺已被确定为尿毒症毒素,可加速肾纤维化的进展。图5b显示了慢性肾病大鼠的多胺代谢途径。
肠道菌群对宿主代谢活动的影响已被广泛研究,其对局部和全身代谢都有很大贡献。为了进一步探索临床指标、细菌属和代谢物之间的关联,使用9个临床指标、13个属级细菌分类群、甘氨酸代谢途径中的7个代谢物和多胺代谢中的6个代谢物的网络分析,如图5c所示,CCr与肠道微生物群的生物失调、临床指标和代谢物直接相关,这表明肾功能下降与导致肾纤维化的微生物组成、甘氨酸代谢和多胺代谢相关。肠道微生物群与甘氨酸代谢和多胺代谢密切相关。有趣的是,高血压与甘氨酸代谢和微生物群的失调呈高度正相关;然而,CCr与NX大鼠体内上调的多胺代谢和微生物群有较高的负相关,着重说明了NX大鼠体内微生物丰度的强烈变化与代谢调控之间的联系。
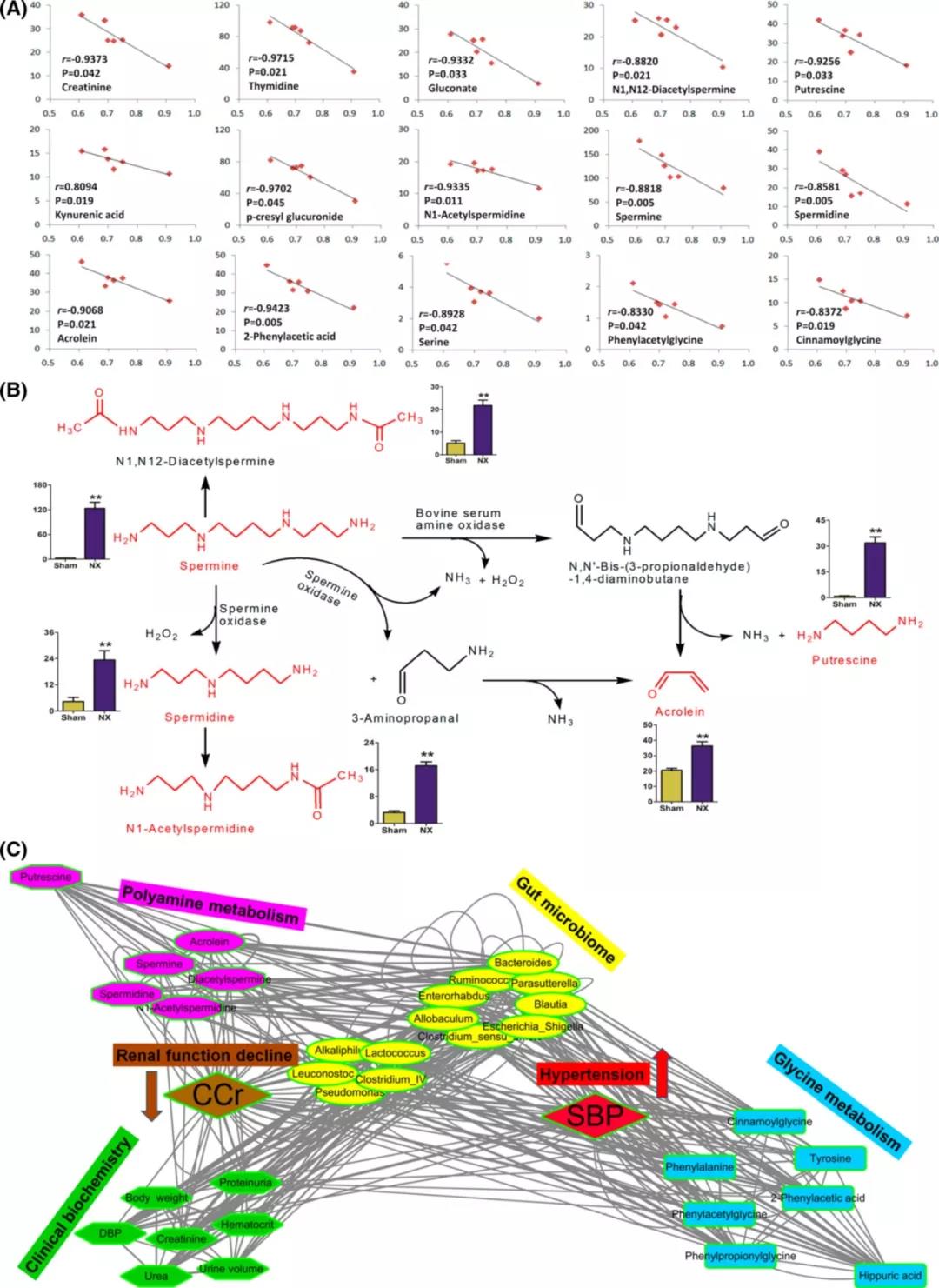
图5
PAA和PC对慢性肾病大鼠肠道菌群、血清代谢产物和肾纤维化的影响
为了证明肠道微生物群是否能影响肾纤维化,慢性肾病大鼠接受了PC治疗,PC是一种著名的天然真菌,对慢性肾病具有显著的抗氧化、抗炎、抗菌、利尿和抗纤维化作用。PAA是PC的主要四环三萜衍生物。如图6a、6b所示,用PAA和PC处理改善了慢性肾病大鼠的甘氨酸和多胺代谢。有趣的是,PAA处理对甘氨酸代谢的影响比PC强。与PAA相比,PC处理在多胺代谢上相对更突出。此外,新出现的证据表明,肠道微生物群的改变在一定程度上是高血压、尿毒症毒素积累和肾功能下降的原因。推测PAA通过降低血压改善肾功能并减轻间质纤维化。然而,PC通过减少多胺衍生尿毒症毒素的产生,部分改善了肾功能,减少了纤维化。目前的研究表明,用PAA和PC治疗可以减轻慢性肾病及其后果(图6c)。值得注意的是,PAA治疗对改善肾功能的作用强于PC,这表明高血压对慢性肾脏病进展的贡献。此外,PAA和PC处理都能上调Z01、occludin和claudin-1的蛋白表达(图6d,e)。
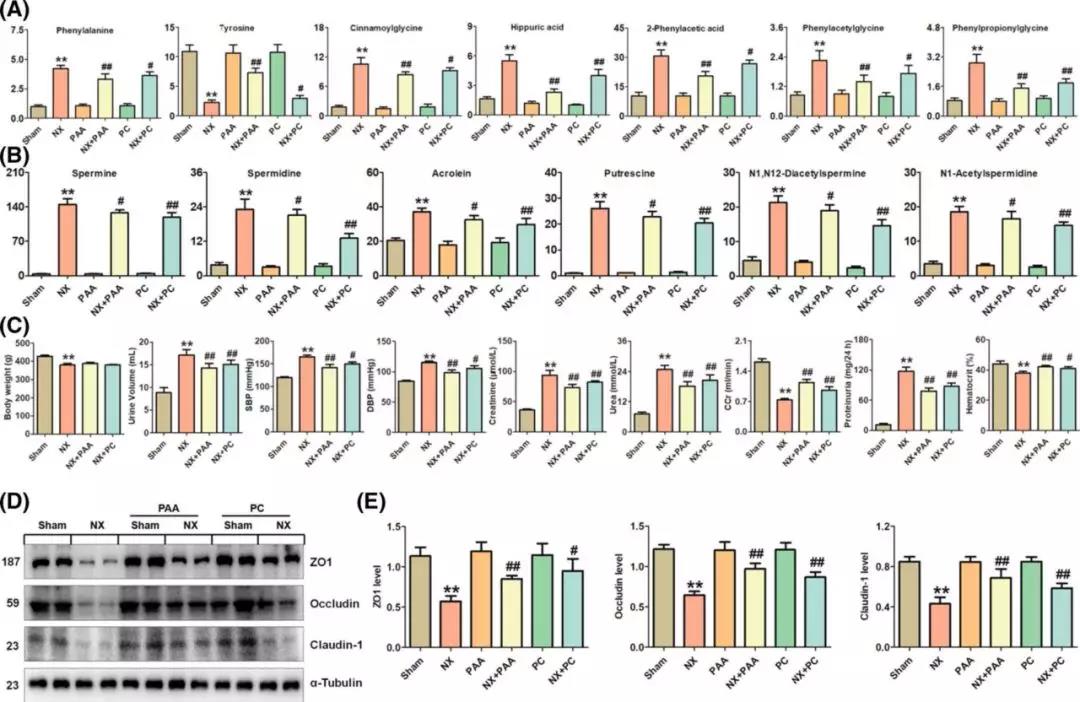
图6
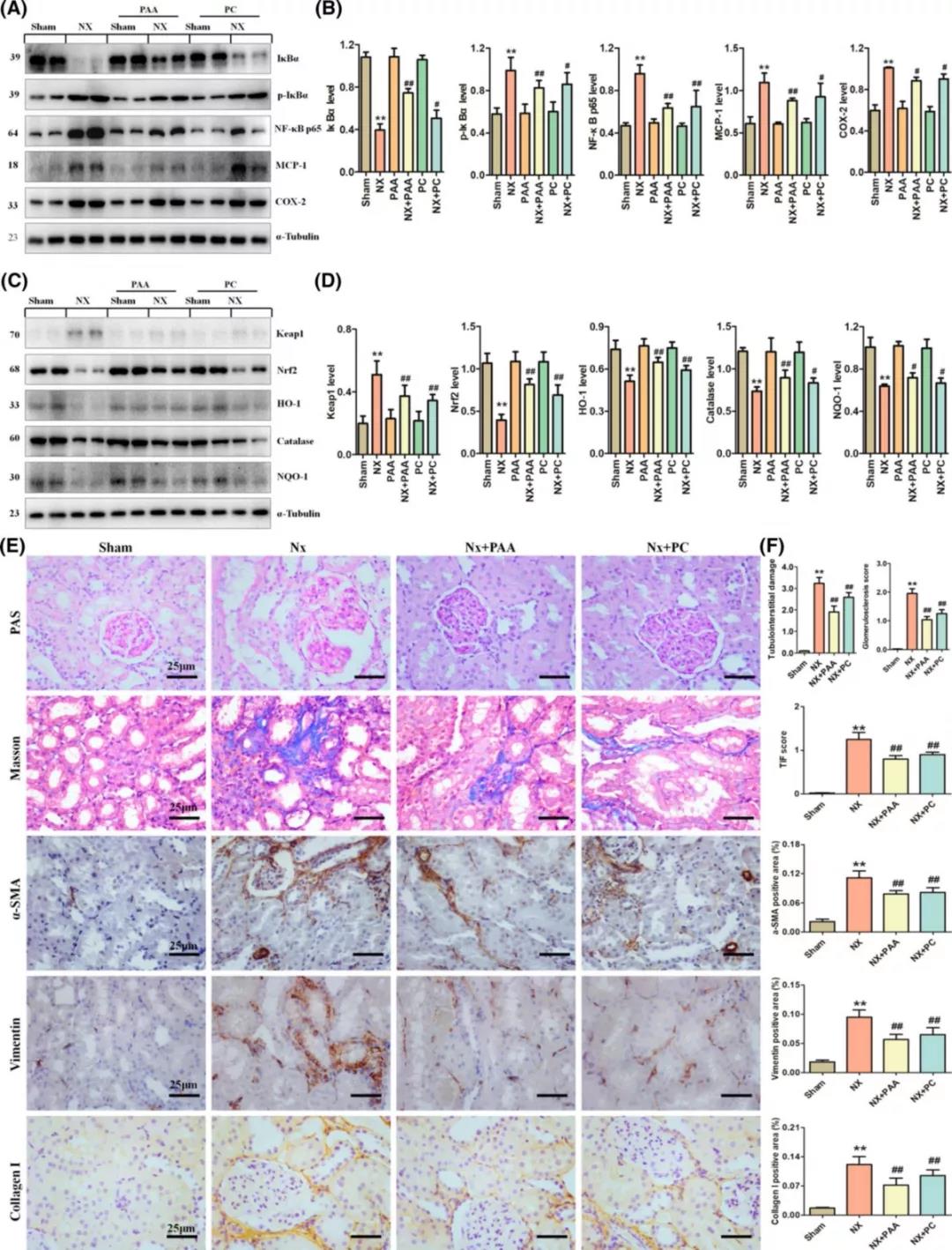
肠上皮屏障的破坏触发了局部和全身炎症和白细胞的流入,并加速了尿毒症毒素在慢性肾病患者和动物的体循环中的转移。NX大鼠表现出p65的显著上调,这表明核因子κB信号的激活(图7a)。κBα/NF-κB的激活伴随着炎症蛋白(包括单核细胞趋化蛋白-1和环氧合酶-2)的显著上调,以及抗氧化系统(包括Nrf2及其下游基因产物,如HO-1、过氧化氢酶和NQO1)的下调(图7a-d)。PAA和PC处理均抑制κB/核因子-κB通路的上调,并阻止细胞保护性Keap1/Nrf2通路的下调。有趣的是,PAA对这些途径的影响比PC更强(图7a-d)。
氧化应激和炎症在慢性肾病的发病和进展中起着至关重要的作用。与sham组相比,慢性肾病大鼠出现间质炎症细胞浸润和肾小管萎缩/扩张(图7e)。组织学分析表明,PAA和PC酯治疗均显著减轻肾损伤(图7f)。免疫组织化学染色显示,用PAA和PC处理均抑制包括α-SMA、vimentin和collagen Ⅰ内的前纤维化因子的上调(图7e)。这些结果表明PAA和PC治疗可以减轻慢性肾病大鼠的炎症和氧化应激,并通过减轻微生物的生物失调、防止肠上皮屏障的破坏和减轻血清代谢物的失调来延缓肾纤维化。
转载于迈维代谢





 浙公网安备33010802007965号
浙公网安备33010802007965号