细胞生命活动会产生数千种的代谢小分子,这些小分子不仅仅是蛋白质(酶)催化的产物,同时也能够反过来通过共价修饰的方式影响蛋白质的功能。例如,乙酰CoA是TCA循环的重要产物,以此为供体所产生的蛋白质乙酰化修饰,在基因表达调控、代谢和信号转导通路调节、癌症发生发展等过程中都发挥了重要的作用。从应用的角度来看,组蛋白去乙酰化酶的抑制剂(HDAC inhibitor)也已经作为一类临床药物在使用。因此,揭示这种蛋白质-代谢物的相互调节机制,对于理解生命的变化、 疾病的发生、诊断和治疗, 具有重大的科学意义。
从生化本质上来说,各类小分子和蛋白质共价结合发生修饰应当是一种普遍的机制。但目前已知的这类修饰仍然非常有限,究其原因是缺乏很好的研究思路和方法,而高精度质谱技术的发展无疑为这个领域的进展提供了强大的武器。然而,传统的质谱方法是用于检测“已知”的质量偏移,能否用来发现全新的修饰类型呢?
为解决这个重要问题,芝加哥大学的赵英明教授团队于2009年在PNAS上发布了一种寻找新的质量偏移的软件工具PTMap[1],为后续新型修饰的发现奠定了基础。自此以来,赵英明教授课题组陆续发现了丙酰化、丁酰化、巴豆酰化、琥珀酰化、丙二酰化、戊二酰化、二羟基异丁酰化、三羟基丁酰化以及苯甲酰化等多种修饰[2-3],极大丰富了人们对酰化修饰的认识和理解。其中赵英明教授课题组2011年发表在Cell杂志上的关于组蛋白巴豆酰化的研究被该杂志评为2011年5篇研究亮点之一;2010年12月在线发表的关于组蛋白琥珀酰化的研究入选自然子刊Nature Chemical Biology创刊十年的39篇精品论文之一。这一系列新修饰的发现使得已知的组蛋白修饰位点数目超过了500个,其中一半以上是由赵教授课题组所发现的,这些工作极大扩充了人们对组蛋白密码(histone code)的理解[4]。
除了发现这些新的修饰类型和位点,赵英明教授课题组还与其他课题组通力合作,共同致力于鉴定这些新修饰的调节蛋白,包括修饰酶(writer)、去修饰酶(eraser)和修饰结合蛋白(reader),研究其生物学功能(调节转录和代谢),并探索其在人类疾病中的作用。上述一系列研究成果已发表在Cell Metabolism、Nature Chemical Biology、Molecular Cell等杂志上[2]。据此,赵英明教授课题组提出的组蛋白酰化修饰的工作模型:细胞代谢通过酶催化的组蛋白酰化修饰重新编程并调控基因的转录,给后续该领域的研究提供了重要的指导意义。
随着研究的不断深入,这九种新的修饰类型陆续被证明同肿瘤、神经、免疫和微生物代谢,以及各种疾病包括肥胖、心血管病、糖尿病和炎症性肠病等多种生理病理过程都密切相关,为这些方向的研究提供了新的思路。赵英明教授课题组在新型蛋白质修饰和组蛋白修饰表观遗传学通路的发现、新修饰的调节蛋白和功能研究等方面均做出了国际领先的开创性贡献。
近日,芝加哥大学赵英明教授课题组、Lev Becker教授课题组再获新突破,在国际顶级学术期刊Nature以research article的形式在线发表了题为“Metabolic regulation of gene expression by histone lactylation”的论文,报道了最新发现的组蛋白赖氨酸乳酸化修饰(Lactylation)及其功能。

2019年的诺贝尔生理学或医学奖授予了三位在“细胞如何感知和适应氧气供应”方面取得突出贡献的三位科学家,这是因为氧气的感知和能量的代谢广泛参与各类生理病理过程。例如肿瘤中有其特殊的能量代谢特征,被称为温伯格效应(Warburg effect),具体表现为即便在有氧条件下也会倾向于采用糖酵解的方式获取能量并出现乳酸的大量聚集[5-6]。但长期以来,这种积累的乳酸一直被视为一种单纯的细胞能源物质和代谢产物,并没有认识到其在生物学功能中的重要调控作用。而本篇论文发现,代谢过程中积累的乳酸可以作为前体物质导致组蛋白赖氨酸发生乳酸化修饰,并参与细菌感染的M1巨噬细胞的稳态调控。该研究不仅为蛋白质的翻译后修饰研究开辟新的领域,也为代谢产物乳酸在肿瘤、免疫等领域参与的研究指引了新方向。
赵英明教授课题组的张迪博士和洛克菲勒大学的Zhanyun Tang博士为该论文共同第一作者,参与本研究的还有洛克菲勒大学的Robert G. Roeder教授(美国科学院院士,拉斯克奖获得者),加州大学圣地亚哥分校的任兵教授,四川大学华西医院的戴伦治教授、中科院上海药物所的黄河教授等。
研究速读
1. 组蛋白乳酸化修饰的鉴定和验证
已有的研究显示,组蛋白酰化修饰通常以细胞代谢物为供体,并可以通过质谱测定修饰基团的质量偏移被发现[7-8]。依此方法,在MCF7核心组蛋白水解肽段的LC-MS/MS实验中,研究者观察到赖氨酸残基上存在72.021道尔顿的质量偏移,并推测该偏移可能是由于赖氨酸上添加了一个乳酸基团所致(图1a-b)。
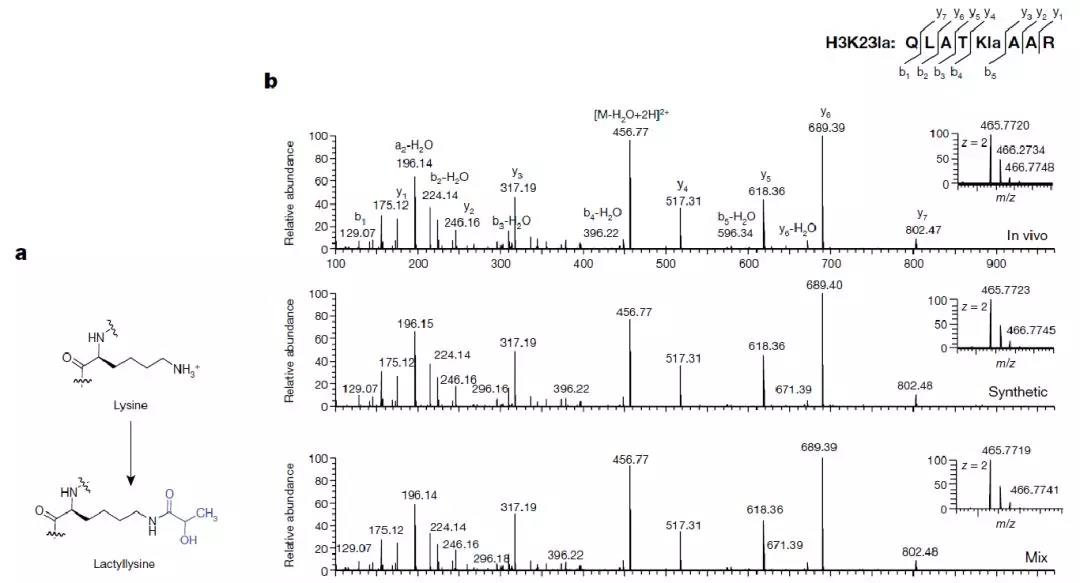
图1. 组蛋白乳酸化修饰发现
通过人工合成肽段与体内肽段质谱图谱比较,作者确证该质量偏移是由一个乳酸基团修饰引起的(图1b)。为了更好地研究乳酸化修饰,作者利用针对乳酸化修饰的泛抗体(景杰生物开发)进行Western Blotting检测(图2d)。此外,作者在Hela和BMDMs细胞中分别鉴定到26和16个组蛋白乳酸化修饰位点(图2c)并通过同位素标记的代谢流实验证明该修饰来源于乳酸。以上的实验结果综合表明,组蛋白乳酸化修饰是一种细胞内来源于乳酸的蛋白翻译后修饰。
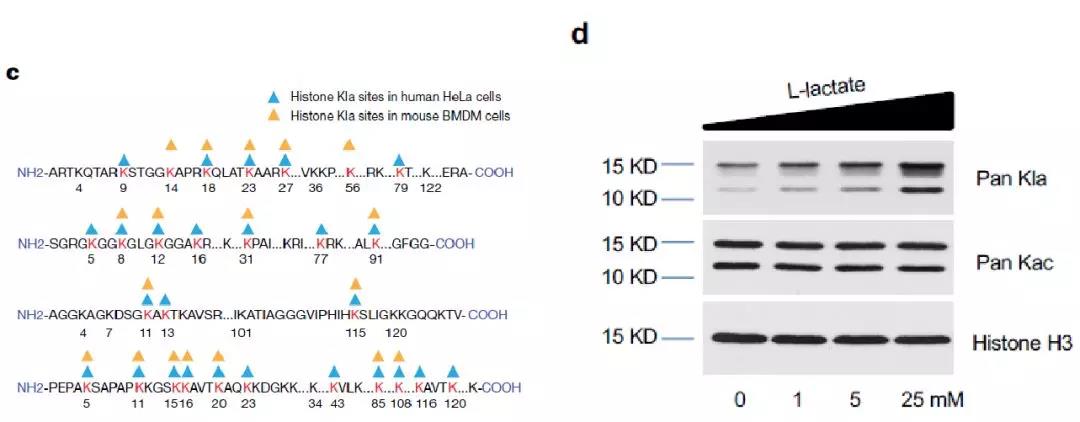
图2. 组蛋白乳酸化修饰验证
2. 组蛋白乳酸化修饰来自糖酵解通路
接下来作者进一步探究组蛋白组乳酸化修饰是否会受到细胞内乳酸的调控。首先,作者用不同浓度的葡萄糖处理MCF-7细胞后发现细胞内乳酸的生成和组蛋白乳酸化修饰水平都呈梯度增加(图3a-b)。乳酸的产生是由糖酵解和线粒体氧化磷酸化共同调控。当用糖酵解抑制剂DCA和Oxamate处理细胞后,乳酸生成和组蛋白乳酸化修饰显著下调;线粒体呼吸抑制剂Rotenone处理细胞后,乳酸生成和组蛋白乳酸化修饰显著上调(图3f-i)。因此可以表明,内源糖酵解通路生成的乳酸是组蛋白乳酸化修饰调控的关键因子。
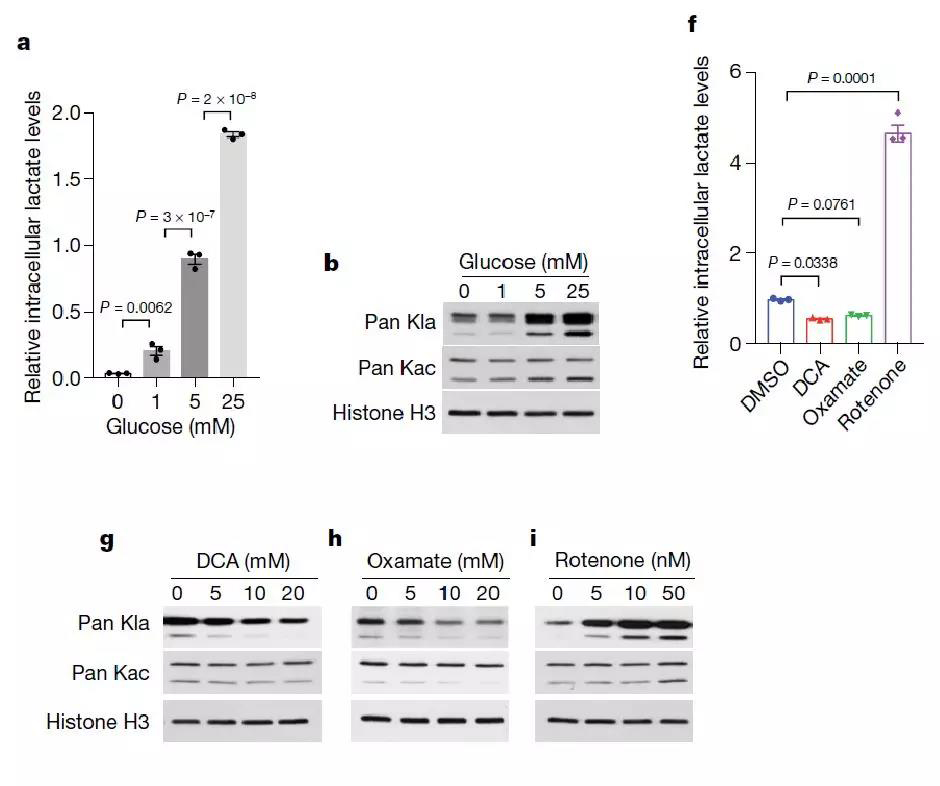
图3. 内源生成的乳酸是组蛋白乳酸化修饰的关键调控因子
3. 低氧条件和M1巨噬细胞极化过程中组蛋白乳酸化修饰增加
为了进一步研究组蛋白乳酸化修饰是否在生理条件下受到糖酵解过程的调控,作者选取了两个实验模型:低氧和M1巨噬细胞极化。实验结果显示在低氧条件下,乳酸生成增加并且组蛋白乳酸化修饰水平显著上调,但是组蛋白乙酰化修饰基本无变化(图4j-k);同时,LPS/IFNγ刺激条件下,M1巨噬细胞乳酸生成和组蛋白乳酸化修饰显著上调,但是对M2巨噬细胞无影响(图4a-d)。由此可见,生理条件下糖酵解过程生成的乳酸促进组蛋白乳酸化修饰。
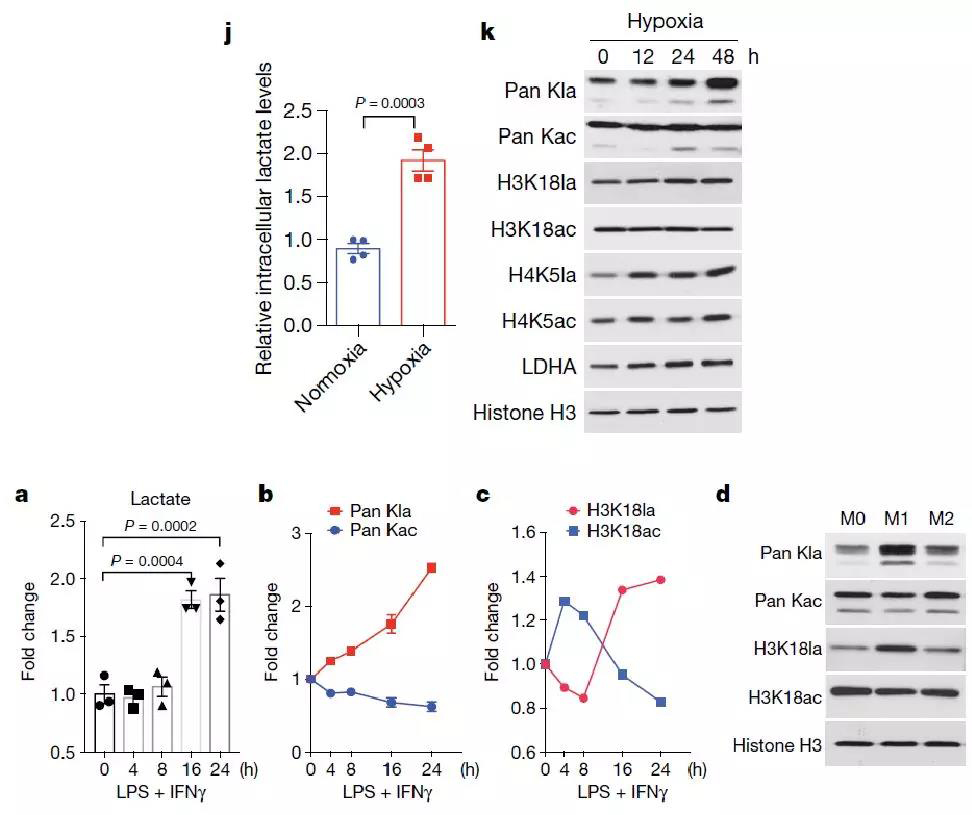
图4. 低氧条件和M1巨噬细胞极化过程中组蛋白乳酸化修饰
4. 乳酸直接通过组蛋白乳酸化修饰活化M2相关基因表达
已有的研究显示,组蛋白组修饰在基因表达调控过程中发挥重要作用。进一步通过ChIP-seq和RNA-seq实验,作者发现H3K18la在一些特定基因的启动子区域富集。这些基因参与多种生物学过程,其中包括与M2巨噬细胞类似表型相关的wound healing通路(e.g. Arg1)(图5e-h)。接下来,作者又通过条件性敲除小鼠的体内实验证明了糖酵解关键酶LDHA敲除后,乳酸和组蛋白乳酸化水平显著降低,并且减少Arg1基因表达水平(图5a-d)。因此可以得出,在M1巨噬细胞极化后期,组蛋白乳酸化修饰增多促进参与损伤修复过程的稳态基因的表达。
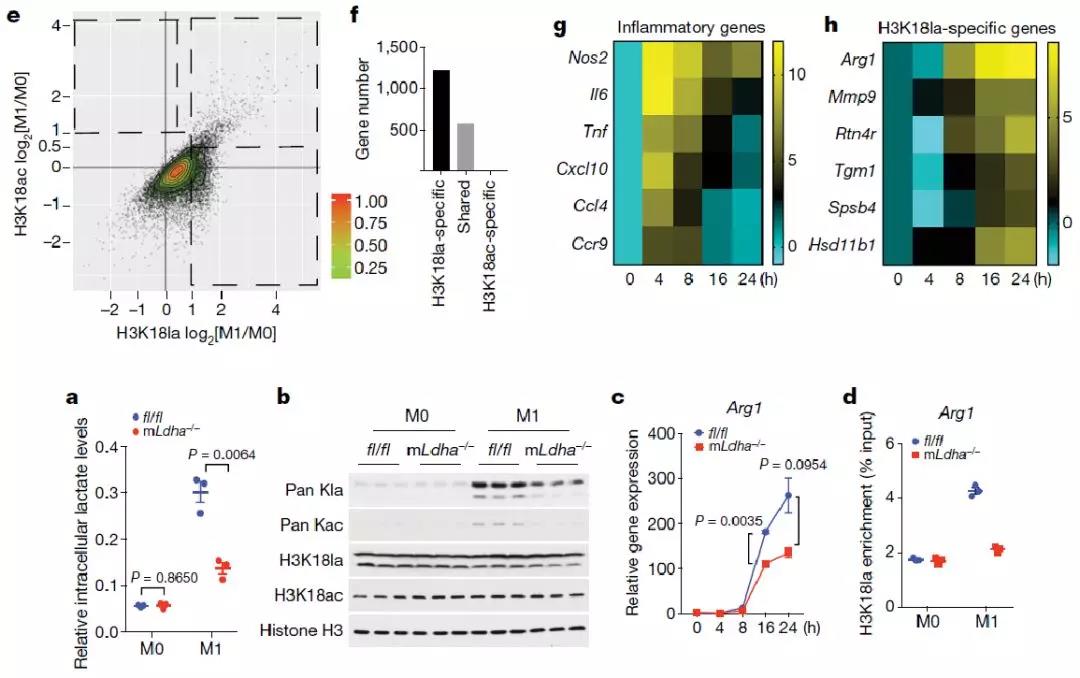
图5. 乳酸直接通过组蛋白乳酸化修饰活化M2相关基因表达
专家点评
Kathryn E. Wellen教授(宾夕法尼亚大学)
Nature同期发表了宾夕法尼亚大学的Kathryn E. Wellen教授的评述文章“Lactate links metabolism to genes”。该评述总结了整个研究的内容并进一步指出了该研究的科学意义。
细胞代谢过程中产生的代谢小分子不仅仅是重要的物质和能量来源,这些小分子也能够调控细胞信号和基因表达,其中一个重要的途径就是通过共价修饰的方式影响蛋白质比如组蛋白的翻译后修饰。近日,芝加哥大学赵英明教授的最新Nature文章在这个研究方向取得了新的突破。
研究者运用质谱技术鉴定了组蛋白乳酸化新修饰并通过同位素代谢标记技术以及多种体内外实验验证了该修饰广泛存在。在模拟细菌感染的模型中,研究者证明M1巨噬细胞极化后期,组蛋白乳酸化修饰增多促进参与损伤修复过程稳态基因的表达。同时,作者比较了组蛋白乳酸化和乙酰化修饰的动态调控,发现乳酸化标记到组蛋白的时间相对更晚,提示这两种修饰可能存在不同的调控方式。进一步,作者提出了“lactate timer”这个全新的工作模型,即组蛋白乳酸化修饰与稳态基因、炎症相关基因表达的动态调控。
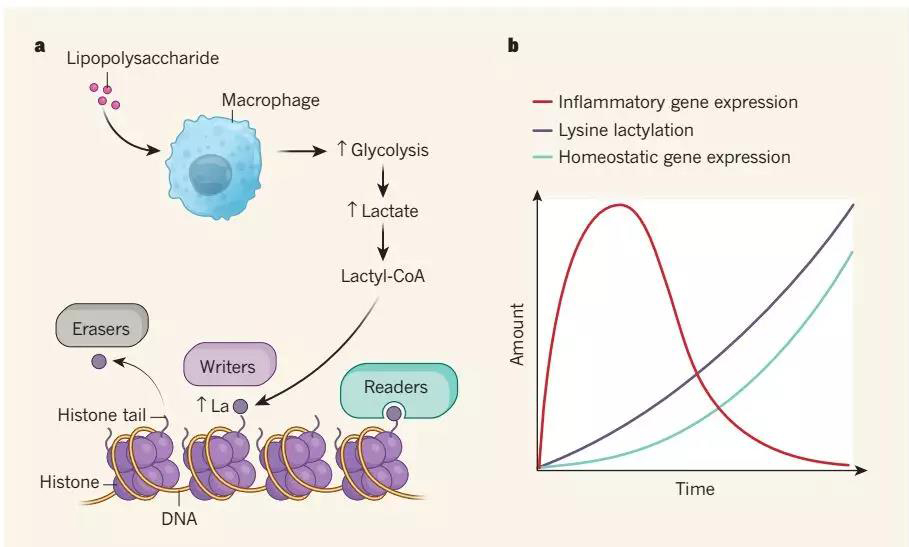
图6. 表观遗传调控新发现-组蛋白乳酸化修饰
本篇研究不仅发现了组蛋白乳酸化修饰这种全新的表观遗传调控方式,还拓展了人们对于乳酸化修饰的生化调控模型以及潜在生理病理功能的认识。在生化调控方式上,作者已经进行了深入研究并发现p300可以在体外催化乳酸基团从lactyl-CoA转移到组蛋白上,但是细胞内是否也存在这样的调控机制目前还不清楚,对于催化中间产物lactyl-CoA产生的酶以及组蛋白乳酸化修饰的"writer" 、" eraser "和" reader" 还有待进一步研究。在潜在生理病理功能方面,作为一种广泛存在的代谢物质,乳酸所介导的新型组蛋白修饰不论是在肌肉运动等生理过程,还是癌症等病理学过程中,都将发挥重要的作用。
参考文献:1. Chen Y, et al. (2009) PTMap--A sequence alignment software for unrestricted, accurate, and full-spectrum identification of post-translational modification sites[J]. Proceedings of the National Academy of Sciences.2. Sabari B R, et al. (2016) Metabolic regulation of gene expression through histone acylations[J].Nature Reviews Molecular Cell Biology.3. Huang H, et al. (2018) Lysine benzoylation is a histone mark regulated by SIRT2[J]. Nature Communications.4. Huang H, et al. (2014) SnapShot: Histone Modifications[J]. Cell.5. Pavlova N, et al. (2016) The Emerging Hallmarks of Cancer Metabolism[J]. Cell Metabolism.6. Palssonmcdermott E M, et al. (2013) The Warburg effect then and now: from cancer to inflammatory diseases[J]. Bioessays News & Reviews in Molecular Cellular & Developmental Biology.7. Kaelin W, et al. (2013) Influence of Metabolism on Epigenetics and Disease[J]. Cell.8. Tan M, et al. (2011) Identification of 67 Histone Marks and Histone Lysine Crotonylation as a New Type of Histone Modification[J]. Cell.9. Di Zhang, et al. (2019) Metabolic regulation of gene expression by histone lactylation. Nature.
原创: Dr.Proteomics 精准医学与蛋白组学





 浙公网安备33010802007965号
浙公网安备33010802007965号