精神分裂症是一种重性精神疾病,其特点是存在一系列症状,包括阳性症状(幻觉、妄想、异常集中和运动障碍)、阴性症状(冷漠、缺乏快感、贪婪和扁平化),以及认知症状(管理功能和注意力方面的缺陷)。虽然精神分裂症的主要病因尚未被确认,但有大量证据表明基因DNA序列的变异、表观遗传修饰改变以及蛋白表达水平差异在精神分裂症的发病机制中起着重要作用。
近日,来自芬兰东方大学维尔塔宁分子科学研究所以及赫尔辛基大学神经科学中心的Šárka Lehtonen 教授、Jari Koistinaho教授团队将相关研究成果共同发表在了NatureCommunications上。研究者使用诱导多能干细胞衍生的神经元进行建模,并且使用诱导自精神分裂症的单卵双胞胎多能干细胞衍生的神经元,从而最小化遗传异质性,增强疾病特异性信号。蛋白质组学分析结果揭示了精神分裂症更多地与糖胺聚糖、GABA能突触、唾液酸化和嘌呤代谢途径的改变相关。cAMP和WNT信号通路、神经元分化和突触功能也可能在家族性精神分裂症和携带渗透性遗传变异的患者中发生改变。

研究同时发现了精神分裂症的性别特异性:尽管在健康的男性和女性之间,所有19462个基因中只有12%表达差异,但多达61%的疾病相关基因是性别特异性的。这意味着病理生理学在男性和女性之间存在差异,并且可以解释为什么症状通常出现在青春期后,以及许多性别特异性基因的表达发生变化,并表明了需要性别特异性治疗。
研究精读
1、与家族风险相关的RNA表达分析
首先,选取六人作为健康对照,同时选取五对不一致的同卵双胞胎作为实验组(两对有精神分裂症家族史)产生并充分表征了iPSC系(病例样本来源)。PANSS评分在30到49之间认为健康(未受影响,表示为HT),PANSS评分在53至113(受影响,表示为ST)。作者选择将细胞分化为表达GABA能和谷氨酸能神经元标志物的皮质神经元,主要因为它们是精神分裂症中受影响最严重的细胞之一(图1)。
图1g显示了HT双胞胎和健康对照(与没有临床疾病的精神分裂症的家族风险相关)、ST双胞胎和健康对照(与家族风险和临床疾病相关)、 ST和HT的双胞胎之间(纯粹与临床疾病相关)差异表达基因(DEG)的数量。图2e结果表明RPS4Y1和DDX3Y是男性双胞胎中有共同家族风险的最强信号,并且这些Y染色体基因的上调表达的效应非常大。此外,CHL1,CNTN4,Shisa6,GAD1和GAD2也是男性家族性风险的强烈信号。
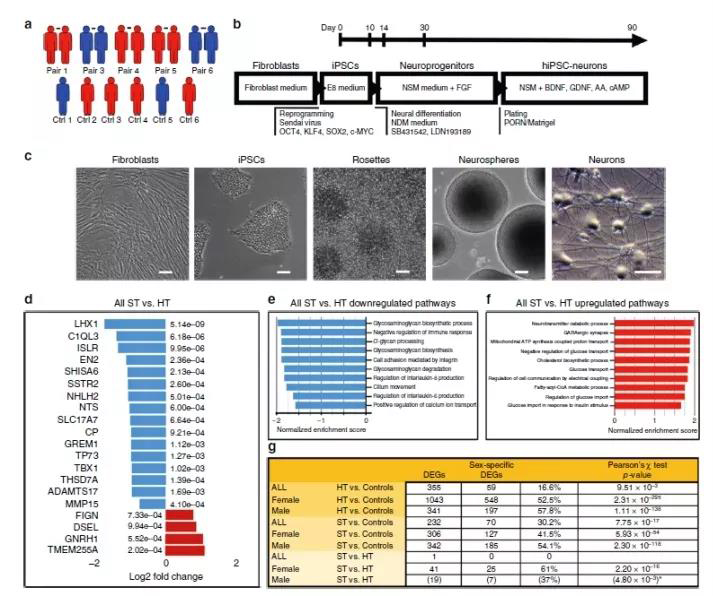
图1 hiPSC衍生的神经元的RNA表达分析
2.性别特异性基因表达
以往的研究认为性别是与精神分裂症相关的基因表达变化的主要决定因素,因此作者比较了健康对照中的雄性与雌性情况。来自所有19462可检测基因中的2327个基因显示出性别特异性表达,并且最高有246倍表达差异和964个显著富集途径。在女性HT的双胞胎中,41个基因显著不同,并且有25个基因属于性别特异性基因(图2c)。在ST与HT的雄性双胞胎的比较中,具有显著性的19个基因中有7个是性别特异性的。
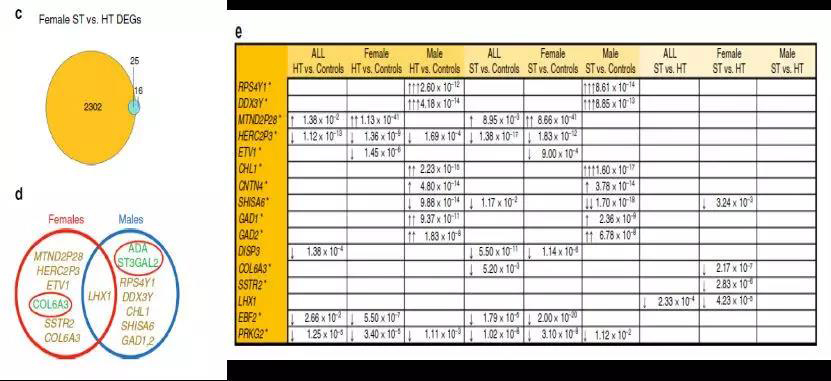
图2 不同组间基因表达比较以及性别特异性DEGs
综上,研究结果表明,大部分与疾病相关的基因都是性别特异性的。尽管男性和女性在精神分裂症中具有许多最终的分子途径,但精神分裂症的潜在主要病理生理学在男性和女性之间明显不同,并且可能有助于该疾病的性别依赖性特征。
3.蛋白质组学分析
众所周知,mRNA和细胞中相应的蛋白质水平相关性通常比较差。为了研究在精神分裂症在不一致的单卵双胞胎的皮质神经元蛋白质表达是否发生变化,作者对肽段、磷酸肽段和蛋白质水平进行了蛋白质组学分析(10标TMT,样本策略)(图3a-c)。在所有5个ST和5个HT的双胞胎的比较中,发现60个蛋白质具有差异表达 (比如CAMK2G、PPP1R17、磷酸甘露糖苷酶1、ST3GAL2和SLC36A4) 以及存在379个具有标称显着性的富集途径(图3d)。
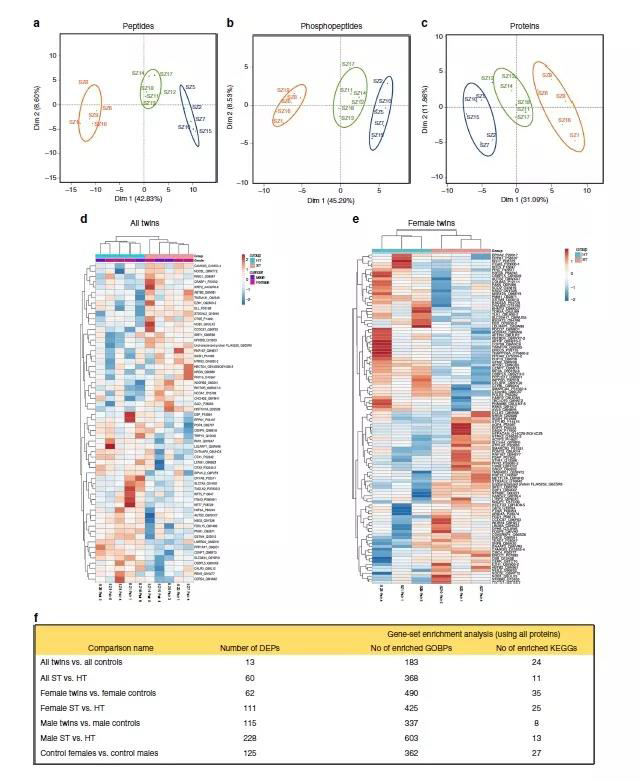
图3 hipsc衍生的神经元的蛋白质组学分析
在雌性和雄性中分别进行蛋白质组学分析显示,当使用性别汇集时,差异表达的精神分裂症相关蛋白和富集途径更多。在女性中,ST双胞胎与健康的共同双胞胎不同,有111种蛋白质和450种具有意义的通路改变(图3e,f)。女性中最一致的发现是CAMK2G的上调,可将ST双胞胎与HT的共同双胞胎区分开来。相应地,在雄性中ST双胞胎与未受影响的共同双胞胎有228个差异表达蛋白和616个富集途径(图3d-f)。在这些蛋白质中,腺苷脱氨酶(ADA)和ST3GAL2表现出最强烈的变化。另外,差异表达的蛋白质与来自精子分裂症不一致的同卵双胞胎的皮质神经元中的DEGs不对应,除了COL6A3和COL6A3的下调(图2g),这也是ST对比中基因表达中最有力的发现。
总之,研究结果发现了精神分裂症在蛋白质和基因表达方面的剧烈变化,并且以性别特异性方式与中枢神经系统发育和各种其他途径相关联。此外,iPSC衍生的皮质神经元中的mRNA和蛋白质表达在健康的男性和女性中也都是不同的。
4. 电生理分析
NMDA受体和GABA能中间神经元都与精神分裂症的病理学有关,NMDA受体的功能障碍被认为是解释精神分裂症症状的主要机制。研究已经揭示调节GABA能神经元和谷氨酸能通路的基因和蛋白质的改变。作者接下来比较了双胞胎TRS及其健康的共同双胞胎的双胞胎之间,神经元中的GABA和谷氨酸的钙反应以及如何响应标准抗精神病药。
由于该阶段的iPSC衍生神经元对应于妊娠中期早期的发育阶段,因此GABAA反应在培养物中具有去极化作用。将不含镁的甘氨酸与谷氨酸一起加入,以优先刺激NMDA受体。在双对TRS中,氯氮平治疗之前或之后,健康和ST双胞胎之间对GABA的钙响应没有显着差异(图4),而在非TRS病例的双对中,响应显著较小。这些数据表明神经元钙反应的调节在TRS和精神分裂症中对标准抗精神病药的反应受到差异,并且氯氮平治疗可以消除精神分裂症患者的胚胎状态神经元中对GABA和谷氨酸的改变的神经元钙响应。
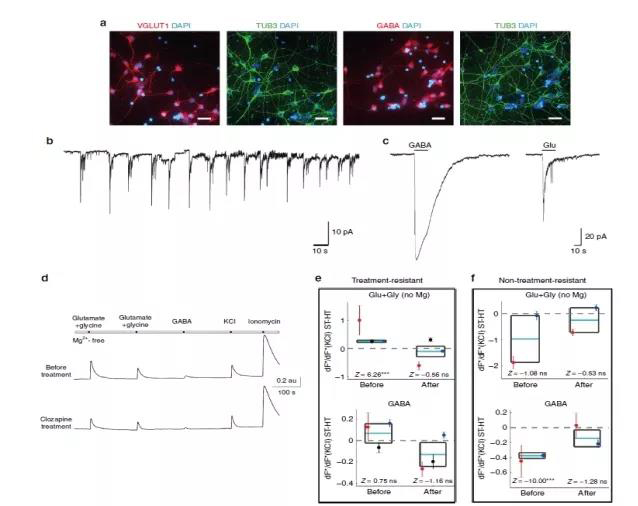
图4 受影响和未受影响的双胞胎自发性神经元活动和神经元钙成像
综上所述,运用蛋白质组学技术和转录组技术,研究揭示了对精神分裂症中iPSC衍生神经元中GABA和谷氨酸暴露的反应的研究。作者观察到ST双胞胎与健康双胞胎相比,胚胎神经元中NMDA特异性谷氨酸或GABA暴露的异常钙反应,以及氯氮平处理后差异的消失。这也意味着早期氯氮平类型的治疗可能会阻止导致全面疾病发展的级联。但是,该研究的结果是基于少数受试者,还应进一步扩大病例样本量。
总之,通过研究疾病不一致的单卵双胞胎,研究者最小化了iPSC衍生神经元中受影响和健康个体之间的疾病无关噪声,确定了与单卵双胞胎中精神分裂症的共同风险相关的因素,以及与疾病的实际发作相关的分子途径和神经元电生理异常。此外,该研究也指出了精神分裂症的病理生理学在男性和女性之间存在差异,并表明需要针对性别的治疗。 参考文献Tiihonen, J., et al., (2019). Sex-specific transcriptional and proteomic signatures in schizophrenia. Nat Commun.
转载于 Dr.Proteomics 精准医学与蛋白组学





 浙公网安备33010802007965号
浙公网安备33010802007965号