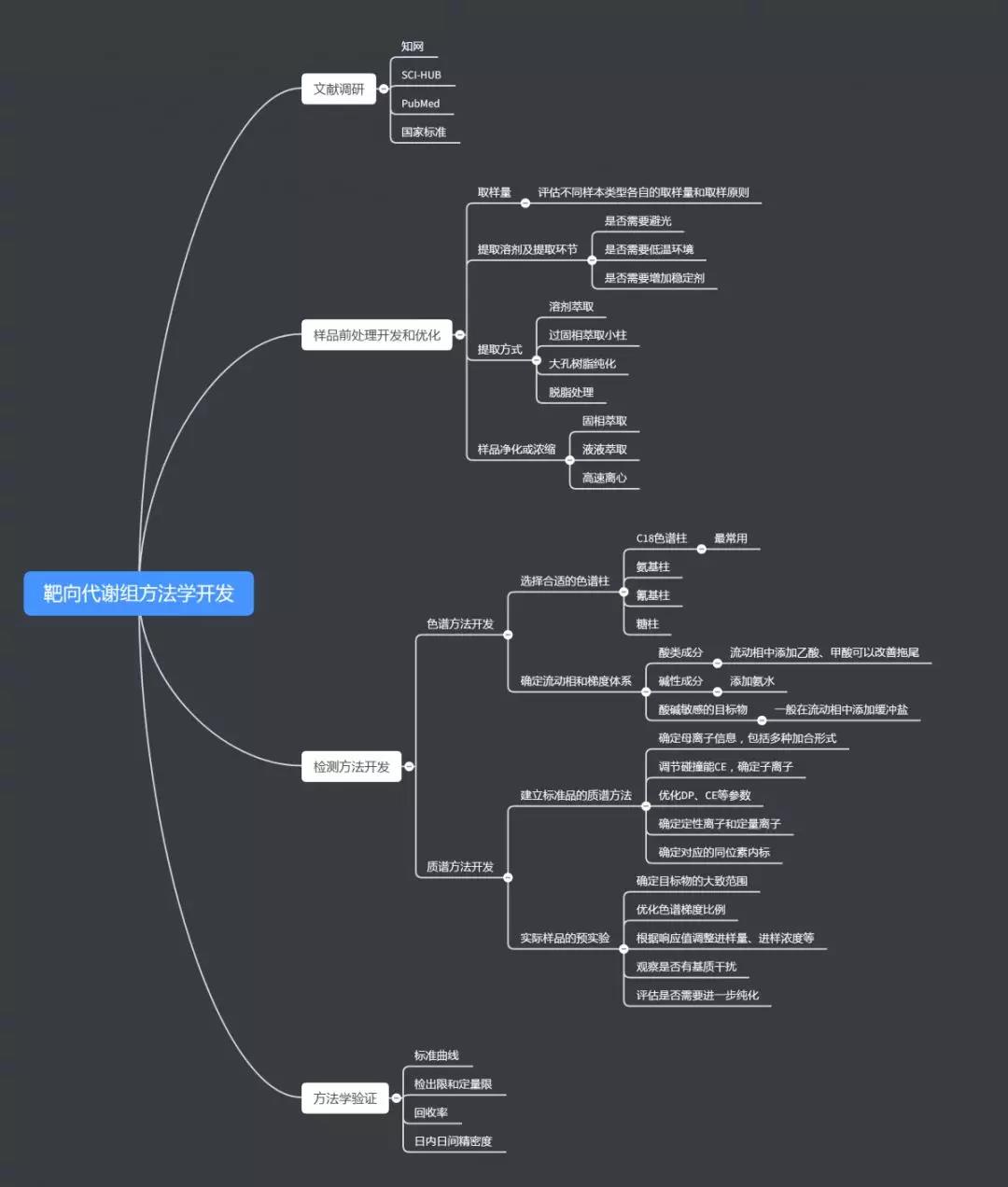
靶向代谢组学属于代谢组学的一个分支,代谢组学和基因组学、蛋白组学等共同组成系统生物学大家庭,如下图:
从代谢组学的角度,靶向代谢组开发是基于广靶分析的再次验证,也就是对生物机体中广泛筛查后的物质成分,给出准确的定量分析结果。主要针对生物机体中分子量小于1000的特定物质或特定类型的成分,包含机体各种代谢途径下的中间产物、底物和或相关标志物,比较常见的类型如氨基酸、核苷酸、糖类、脂肪酸、胆汁酸、氧化脂质等等。
靶向代谢组方法开发常用的有绝对定量和相对定量,其区别在于绝对定量需配制不同梯度的已知浓度标准品,绘制标准曲线计算出准确的含量,而相对定量则无需提供标准曲线及计算准确含量,仅提供目标成分的响应即可。
如何建立科学的靶向代谢组学分析方法?
一般而言,完整的靶向方法开发包含文献调研,样品前处理开发,仪器方法开发,方法学验证等环节。
下面以基于质谱分析建立靶向代谢方法学开发进行说明。
文献调研
查阅国内外学术期刊,分析样品处理方法、检测方法、定量限等,核心的目标是确定方法开发的可行性并给出实验方案。后续的开发过程,都基于文献调研的结果。
首先确定样本的类型和待分析物的类别。每种类别都有各自的理化性质和特点。
其次,文献查询的关键词要准确规范,目的就是为了保证文献查询的精准、全面。文献搜索的范围,包括中英文期刊论文、国家标准或行业标准、相关专利等。如下图显示的是常用的几个搜索工具或数据库:
图1 知网查询

图2 SCI-HUB查询
 图3 PubMed查询
图3 PubMed查询
 图4 国家标准查询
图4 国家标准查询
除此之外,还有百度学术,谷歌学术,Web of science,chemspider,pubchem等网上资源,相关的文献资料也很多。
文献筛选也需要考虑其权威性,同时关注相关领域最权威的实验室和最新的研究文章。
样品前处理开发
由于生物样品的基质复杂,待分析物的含量较低(一般为ng/L或μg/L),因此对方法的灵敏度和精密度有着更高的要求,那么样品前处理就显得尤为重要。通常,前处理优化包含取样量、提取溶剂、提取方式、样品净化或浓缩等。
取样量根据样本特性选择,也根据待分析目标确定,血浆、组织、细胞、尿液等都有常规的取样原则。
提取溶剂的选择主要依据物质的理化信息,可以综合各种文献的结果进行确认,同时需要明确并注意的是样品提取环节,是否需要避光?是否需要低温环境?是否需要增加稳定剂(如抗氧化、调节酸碱度)?等等。
如果目标物在样品含量极低,或目标物受基质干扰较大,需要考虑样品的富集或纯化,常见的方法如溶剂萃取、过固相萃取小柱、大孔树脂纯化、脱脂处理等,具体方案依照文献查询的结果综合考虑。
有时为了提高待分析物的可检测性,可考虑衍生化处理。如用GC-MS方法开发糖类成分、脂肪酸类成分时,就需要考虑采用衍生化试剂处理。
样品前处理方案,是要在保证提取完全的基础上,避免目标物的降解、转化,降低基质干扰,以提高方法的灵敏度。但对于大批量样品的分析,前处理方法还需要考虑过程的简单,避免过多的试剂和提取过程引入的误差。下图所示为常见的几种前处理方法。

检测方法开发
检测方法开发和样品前处理开发是紧密相关的环节,这里以LC-MS/MS为例进行说明(注:LC-MS/MS是代谢组研究中最为常用的方法),主要分两个部分:一是色谱方法,二是质谱方法。
1.色谱方法开发
首先需要决定的是色谱柱类型。常用的是C18色谱柱,特定类型的成分,可以选择其他极性色谱柱如氨基柱、氰基柱、糖柱等,具体可以参照相关专业书籍进行选择。
其次需要确定流动相和梯度体系,流动相的选择和待分析物酸碱性相关。一般而言,酸类成分,流动相中添加乙酸、甲酸等,可以改善拖尾;碱性成分,主要添加氨水等;对酸碱敏感的目标物,一般在流动相中添加缓冲盐。梯度的选择也根据目标物性质进行开发。
文献资料中的方法不能完全照搬,在实际开发的过程中需要进行优化,因为色谱柱品牌不同、仪器性能不同,流出曲线是有差异的,需要根据实验情况选择最为合理的方案,保证待测目标成分和干扰物相互分离,保证较好的响应,以及调整流动相比例优化最佳的出峰时间。
需要特别注意的是,HPLC方法中的流动相并不是都能直接转移到质谱端,难挥发或不能挥发的缓冲盐进入质谱后,容易在离子源处形成结晶体,甚至损坏质谱硬件。如果采用UPLC方法代替HPLC方法,色谱柱、流动相、流速、进样量都应该相应调整。
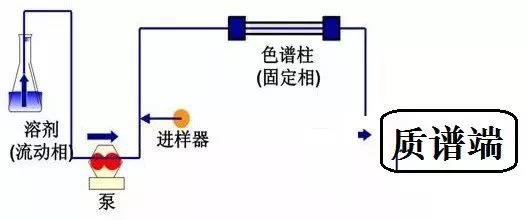
2.质谱方法开发
质谱开发多针对的是三重四级杆质谱,这里涉及到母离子Q1的确认和碎片离子Q3等信息,所以一般而言,质谱方法开发的第一步是建立标准品的质谱方法,通常可通过针泵进样的方式确定离子对信息和检测参数。
例如分析样品中维拉帕米,在文献查阅环节,已明确目标物的分子式、结构式、溶解性。见下图
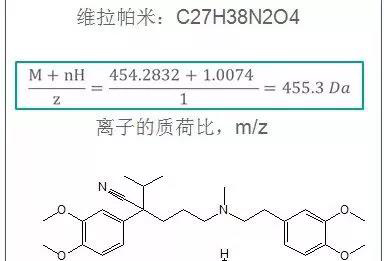
(图片来自 AB SCIEX)
通过针泵直接进样(大致1ppm浓度),在Q1环节,确定找到标准品的母离子。这里要特别注意的是,母离子有很多加合形式,如M+H、M-Cl、M-Na等,所以在判断母离子时,不能仅依照物质的摩尔分子量,还需要考虑目标物的电离特性。在对母离子响应不确定的时候,可以增加梯度浓度的标准品,观察峰面积是否等比例增加。
找到母离子后,需通过调节碰撞能CE,确定碎片离子,即子离子。为了提高子离子的响应,需进一步对碰撞能CE和去簇电压DP等参数进行优化。碰撞能CE不同,碎片的相对丰度不同,根据最大响应值,选择最佳的碰撞能。去簇电压DP是为了消除溶剂离子簇,DP越大,去簇效果越好,DP太大会造成离子源内裂解。
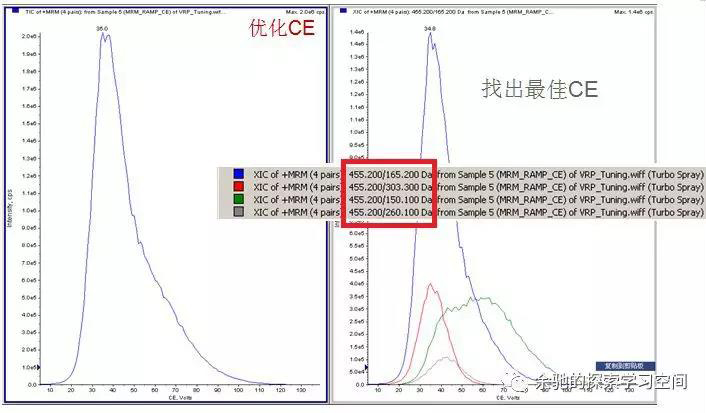
质谱参数的选择还有很多,可以根据实际情况调整,不同的仪器有不同的最佳参数,主要目的是保证待分析物有最佳的响应值。离子对的选择一般至少2组,一组作为定量离子,一组作为定性离子。
标准品开发环节,还涉及内标物质的确定,一般而言,最好的内标物是同位素内标,与标准品有相同的色谱行为,相同的基质效应,可以更为准确的实现目标物的绝对定量。
标准品开发完成后,可以进行实际样品的预实验,确定样品中目标物的大致范围,优化色谱梯度比例,根据响应值调整进样量、进样浓度等信息,同时观察是否有基质干扰,是否需要进一步纯化等等。
方法学验证(仅针对绝对定量方法)
任何方法的开发和应用,都需要一个评价标准,或是一个指导原则,来确定方法的可行性和准确性。质谱分析多涉及生物样品,药典附录中《生物样品定量分析方法验证指导原则》便是一个重要方法学验证参照。这里面定义了方法学考察的要求,也规定了质控指标。
要提交完整的开发方案,方法学验证中至少应该涉及:标准曲线(线性关系)、检出限和定量限、回收率、日内日间精密度等。
标准曲线需要尽量涵盖待测样品的含量区间,一般覆盖三个数量级,并满足相关系数在合理的范围,如下图。建立标准曲线的同时,也需要给出定量限和检出限指标,定量限(LOQ)以10倍噪音为基准。

回收率主要是考察方法的可靠性,一般达到80%-120%之间为宜,由于生物样品的复杂性,存在复杂基质干扰的情况下,待分析物质含量极低的情况下,回收率范围可以适当放宽。
日内日间精密度,为均匀样品多次重复测定所得结果的一致性,在一天之内进行的精密度考察称为日内精密度;在三天之内进行的精密度考察称为日间精密度。
总结
以上是靶向代谢组方法开发的一个基本流程。实际的开发中往往更复杂,可能还涉及质控指标的建立,数学建模分析,报告输出等等。





 浙公网安备33010802007965号
浙公网安备33010802007965号